Потенциал - ионизация - элемент
Cтраница 3
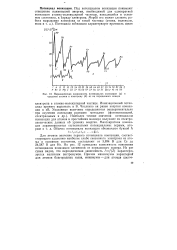 |
Периодическая зависимость потенциалов ионизации ( а и сродства атрмов к электрону ( б от их порядкового номера. [31] |
Для атомов значение первого потенциала ионизации, соответствующего удалению наиболее слабо связанного электрона из атома в основном состоянии, составляют от 3 894 В для Cs до 24 587 В для Не. На рис. 12 приведена зависимость изменения потенциалов ионизации элементов от порядкового номера. Из ри сунка видно, что периодическая зависимость If ( Z) характери зуется наличием экстремумов. [32]
Электронная классификация элементов периодической таблицы позволяет объяснять закономерность в комплексообразовании элементов, распространение элементов в земной коре и целый ряд других явлений. Знаменательным в этом отношении является открытие и создание химии соединений инертных газов, что оказалось возможным при установлении потенциалов ионизации элементов и сравнении их для кислорода и ксенона. [33]
Уменьшаясь по периоду от щелочного металла до галогена, атомный радиус следующего щелочного ме-талла снова увеличивается и становится больше радиуса атома предыдущего щелочного металла. Например, атом лития имеет радиус 0 158 нм, а радиус атома натрия-0 171 нм. Потенциалы ионизации элементов внутри каждой группы сверху вниз уменьшаются, а в периоде слева направо - возрастают. [34]
На интенсивность излучения линии существенно влияет температура плазмы. Наибольшая интенсивность дуговых линий наблюдается при температуре, соответствующей началу заметной ионизации его атомов. По мере повышения потенциала ионизации элемента для получения большей чувствительности требуется более горячий источник. Температурой плазмы чаще управляют, вводя в пробу буфер. Вопросы подбора и применения буфера рассмотрены в предыдущей главе, а также в описании частных методик. Здесь отметим лишь, что с введением в пробу элементов с низким потенциалом ионизации повышается также интенсивность линий однократно ионизированных атомов трудновозбудимых элементов при искровом возбуждении. При введении в пробу около 30 % соединений бария, цезия и рубидия интенсивность линий SII 5453 88 А, О II 4794 54 А и BrII 4785 50 А повышается в 2 - 3 раза. [35]
 |
Ионные радиусы и потенциалы ионизации щелочных металлов. [36] |
Ранее мы указывали, что вдоль каждого периода происходит постепенное увеличение эффективного заряда ядра и уменьшение атомного радиуса. Оба эти эффекта приводят к увеличению потенциалов ионизации. Однако внимательное рассмотрение рис. 6.8 показывает, что это возрастание происходит не всегда равномерно и иногда потенциал ионизации элемента оказывается меньше, чем у предыдущего элемента того же периода. Это объясняется большим проникновением s - электронов к ядру по сравнению с р-электронами того же энергетического уровня ( см. гл. При ионизации бериллия с электронным строением 4Ве Is22s2 происходит отрыв от атома 2х - электрона, в то время как при ионизации бора, имеющего строение 5В Is22s 2pl, отрывается 2р - электрон. По аналогичной причине наблюдается неравномерное изменение потенциалов ионизации и при переходе от 12Mg к 13А1 в третьем периоде, а также при переходе от 30Zn к 31Ga в четвертом периоде. [37]
То, что первые потенциалы ионизации инертных газов намного больше, чем аналогичные потенциалы любых других атомов, является, конечно, следствием исключительной стабильности полностью заполненной оболочки инертного газа и показывает исключительную трудность образования соединений этих элементов. По той же причине вторые потенциалы ионизации щелочных металлов также чрезвычайно велики, так что у этих атомов валентность, превышающая единицу, практически невозможна. При переходе вдоль группы сверху вниз энергии ионизации уменьшаются главным образом за счет увеличения размеров атомов, так что притяжение между электроном и возникающим при его отрыве катионом убывает. Существует еще дополнительный фактор, благодаря которому потенциалы ионизации элементов первого и второго коротких периодов особенно велики. Дело в том, что у этих атомов около ядра имеется сравнительно мало электронов, так что эффективный заряд остающегося иона ( поскольку рассматривается притяжение между ним и электроном) значительно больше полного числа отрывающихся электронов. Другими словами, остающиеся электроны не обеспечивают столь эффективного экранирования ядра, как в следующих периодах. Это является одной из главных причин качественного отличия, которое часто наблюдается между первым и вторым элементами группы периодической системы и последующими элементами той же группы. [38]
По той же причине при переходе к элементам II, III и других групп подобный расчет менее верный, поскольку в данной последовательности энергия взаимного отталкивания электронов в атомах элементов главной и побочной подгрупп становится все более разной. Такая тенденция определяет увеличение различия в строении оболочек птомов элементов главной и побочной подгрупп. В связи с этим результаты расчета отношений потенциалов ионизации по уравнению (19.1) должны все больше расходиться с экспериментальными данными. Эта тенденция приводит к тому, что в III группе ( см. рис. 19.2) потенциалы ионизации элементов главной и побочной подгрупп оказываются близкими по значениям, а в IV и последующих главных подгруппах больше, чем в дополнительных. В результате имеет место серьезное различие в соотношении свойств элементов главной и дополнительной подгрупп по левую и правую сторону от III группы, что нашло свое отражение в построении периодической системы. [39]
Страницы: 1 2 3