Потенциал - окислитель
Cтраница 1
Потенциал окислителя должен быть выше потенциала восстановителя. [1]
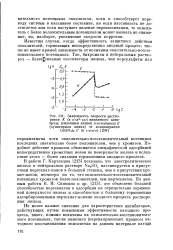 |
Зависимость скорости растворения К ( в г / см2 - час никелевого электрода ( сплошная линия и потенциала Е ( пунктирная линия от концентрации Ce ( S04 2 С ( в г-экв / л. [2] |
Бдительного потенциала окислителя, хотя и способствует переводу системы в пассивное состояние, но если пассивность не достигается или если наступает явление перепассивации, то окислитель с более положительным потенциалом может вызвать не снижение, но, наоборот, увеличение скорости коррозии. [3]
Чем сильнее различаются величины потенциалов окислителя и восстановителя, тем резче изменяется потенциал смеси в момент эквивалентности. [4]
Примером применения комплексообразования для снижения потенциала окислителя является методика фазового анализа медных осадков, получаемых при автоклавном процессе. Этот продукт содержит средний и основной сульфат двухвалентной меди, закись, окись и элементарную медь. Был применен раствор ЭДТА, который дает с ионами двухвалентной меди прочный комплекс - / СнестЫ Ю-19. Таким образом, потенциал системы Cu2 / Cu был резко уменьшен и растворения металлической меди не происходит. [5]
В какую сторону изменяются значения потенциалов окислителя и восстановителя по мере протекания реакций. [6]
В какую сторону изменяются значения потенциалов окислителя и восстановителя по мере протекания реакции. [7]
Чтобы найти ЭДС реакции, нужно из потенциала окислителя вычислить потенциал восстановителя. [8]
Для того, чтобы установить зависимость между потенциалами окислителя и восстановителя, напомним, что переход электронов, или, что то же самое, реакция окисления-восстановления протекает лишь до тех пор, пока существует разность потенциалов. [9]
Реакция возможна и протекает в прямом направлении, когда потенциал окислителя превышает потенциал восстановителя. [10]
В данном случае искажение макроциклического остова так велико, что потенциала окислителей не хватает для его ароматизации. [11]
Для того чтобы определить разность потенциалов, нужно из величины потенциала окислителя вычесть потенциал восстановителя. [12]
Любая ОВР всегда протекает в том направлении, которому соответствует положительное значение разности потенциалов окислителя и восстановителя. [13]
При меньшей концентрации ионов водорода, например в 2 % - ной серной кислоте, потенциал окислителя имеет значение фок. [14]
Образовавшаяся при этом высшая валентная степень МпО при восстановлении до MnOg имеет потенциал более высокий ( Е 1 67 в), чем потенциал окислителя, который вызвал образование пер-мангаяата. [15]
Страницы: 1 2