Потенциал - полуволна - окисление
Cтраница 1
Потенциалы полуволн окисления в ацетонитриле находятся в пределах от 0 21 до 0 51 В и от 0 79 до 1 09 В в воде. [1]
Изменение потенциалов полуволн окисления или восстановления в зависимости от природы растворителя подробно было изучено в ряду т / ис-комплексов марганца ( Ш) и железа ( 1У) и бис-комплексов меди ( П) с анионами 1-пирролидиндитиокарбоновой кислоты. Elef) и параметрами, характеризующими растворители ( те же, что и в работе [120]), была найдена линейная зависимость. [2]
Обстоятельное исследование Вавржина111 показывает, как влияет на потенциал полуволны окисления аскорбиновой кислоты величина рН, а также температура, концентрация желатина и другие факторы. [3]
Как следует из приведенной зависимости, с ростом величины потенциала полуволны окисления фенола скорость реакции уменьшается. Это подтверждает предположение о том, что взаимодействие диоксида хлора с фенолами, скорее всего, протекает по механизму переноса электрона. [4]
Для количественной оценки реакционной способности солей диазония в растворе более пригодны потенциалы полуволн окисления и восстановления, чем потенциалы ионизации и сродство к электрону, хотя между обеими величинами существует линейная зависимость. [5]
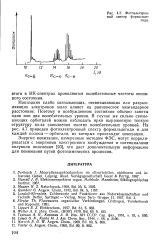 |
Фотоэлектронный спектр формальдегида. [6] |
Энергии ионизации, измеренные методом ФЭС, могут коррели-роваться с энергиями электронного возбуждения и потенциалами полуволн окисления [20], что дает дополнительную информацию для понимания путей фотохимических процессов. [7]
Для подтверждения окислительно-восстановительного механизма образования каталитически активных частиц в исследуемых системах методом анодной полярографии на вращающемся платиновом электроде определены величины потенциала полуволны окисления i ( PPJi3) 2COCI и Ь - ( PPji3) 2COCI и изучено влияние добавок КШ в присутствии и отсутствии молекулярного кислорода на полярографическое окисление указанных комплексов. [8]
Был исследован ряд соединений типа ( XXX), полярографические данные представлены в табл. 9.2. Показательно, что существует линейная корреляция между потенциалами полуволны окисления и энергиями, соответствующими полосам переноса заряда, в оптических спектрах комплексов этих соединений с тетра-цианэтиленом. [9]
При изучении вольтамперометрического поведения 1-пирроли-динкарбодитионатных комплексов марганца ( III), железа ( III) и меди ( II) в неводных растворителях выявлено закономерное изменение величин разности потенциала полуволны окисления и потенциала полуволны восстановления в зависимости от сольватирующих параметров растворителей. [10]
Паркер и Бэрджерт [20] провели сходные эксперименты с толуолом. Потенциал полуволны окисления толуола довольно высок и составляет 2 3 В отн. Было обнаружено, что окисление толуола во влажном ацетонитриле ( 5 5 М Н2О) на фоне LiNO3, NaC104, KC104, LiClO4 или ( C2H5) 4NC104 при потенциалах от 1 6 В до 2 7 В отн. Эберсоном и Найбергом) к N-замещенному амиду, а именно к N-бензилацетамиду. Во влажном ацетонитриле кроме N-бензилацетамида образуются также дибензил, бензиловый спирт, бензальдегид и бензойная кислота. [11]
Удовлетворительные результаты дали покрытые парафином графитовые электроды, рабочая поверхность которых обновлялась обламыванием. При этом оказалось, что потенциалы полуволн окисления подавляющего большинства синтезированных нами соединений находятся в пределах 0 20 - 0 32 в по отношению к потенциалу насыщенного каломельного электрода. [12]
В первой работе по измерению потенциалов полуволн окисления [5] было обнаружено, что добавление пиридина вызывает значительный сдвиг к более отрицательным потенциалам. [13]
Хотя имеющиеся данные не дают точного представления о механизме реакции, ясно, что он включает анодное окисление и циклооктатетраена, и ацетат-аниона. Это вполне приемлемо, так как известно, что потенциал полуволны окисления циклооктатетраена составляет 1 45 В отн. Правда, ацетокси-лирование циклооктатетраена могло бы идти и через его окисление до катиона. [14]
Если считать, что реакция дезактивации обратима, то можно ожидать, что при катодной поляризации будет возникать кинетический ток восстановления, ограниченный скоростью образования Охг из Охг. V / 2 волны восстановления дегидроаскор-биновой кислоты должен быть равен потенциалу полуволны окисления аскорбиновой кислоты. [15]
Страницы: 1 2