Потенциал - разряд - ион - водород
Cтраница 1
Потенциал разряда ионов водорода на других электродах оказывается отличным от потенциала на платинированной платине. Для разряда водорода на других электродах требуются значительно большие отрицательные потенциалы, величина которых зависит от природы взятых электродов. [1]
Эти значения лежат выше потенциалов разряда ионов водорода и, как можно было ожидать, исключают водородное растрескивание. [2]
Вследствие незначительного перенапряжения водорода на никеле потенциал разряда ионов водорода находится в тесной зависимости от концентрации ионов Н в электролите. С уменьшением рН раствора потенциал разряда ионов водорода смещается в сторону электроположительных значений и разряд ионов водорода на катоде облегчается. [3]
Вследствие незначительного перенапряжения водорода на никеле потенциал разряда ионов водорода находится в тесной зависимости от концентрации ионов Н в электролите. С уменьшением рН раствора потенциал разряда ионов водорода смещается в сторону электроположительных значений я разряд ионов водорода на катоде облегчается. [4]
Показано, что введение добавок ПВП приводит к смещению потенциала разряда ионов водорода в область более отрицательных значений. При разряде ионов водорода наблюдается спад токов, как и в отсутствие, так и в присутствии ПВП. Это связано с пассивацией поверхности стального электрода, в результате образования оксидных пленок. [5]
Под термином перенапряжение водорода первоначально понимали разность между равновесным потенциалом и потенциалом разряда ионов водорода с выделением газовых пузырьков. [6]
Чистый цинк в кислом растворе обладает значительно более низким электродным потенциалом, чем потенциал разряда ионов водорода в этом растворе. [7]
Перед выполнением работы необходимо ознакомиться: I) с влиянием рН растворов на потенциал разряда ионов водорода; 2) с зависимостью скорости коррозии разных металлов от рН раствора; 3) с коррозионной стойкостью магния и его сплавов в различных средах. [8]
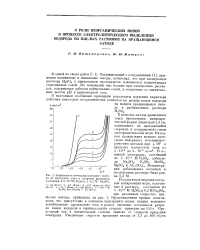 |
Зависимость потенциала медного катода от плотности тока и скорости вращения электрода в 5. ( - % [ H2SOi 0 2 М Na2SO4. [9] |
Представленные кривые показывают, что присутствие в основном электролите ионов натрия вызывает возникновение предельного тока и резкое смещение потенциала разряда ионов водорода в отрицательную сторону примерно на 0 6 в. Предельный ток в значительной степени зависит от скорости вращения электрода. [10]
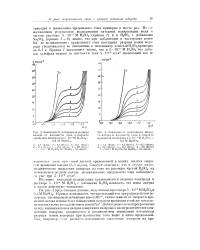 |
Зависимость потенциала мндиого. [11] |
Наблюдаемое некоторое различие между влиянием ионов натрия и марганца па процесс электролитического выделения водорода заключается в неодинаковом повышении потенциала разряда ионов водорода при плотностях тока выше и ниже предельной. [12]
Равномерное и спокойное питание ванны электролитом без перемешивания его, что способствует сохранению возле катода щелочной пленки электролита, увеличивающей потенциал разряда ионов водорода, и уменьшает количество щелочи, поступающей к аноду, и растворенного хлора к катоду. [13]
Прежде всего это относится к щелочным и щелочноземельным металлам, которые восстанавливаются на РКЭ при более отрицательных потенциалах, чем потенциал разряда ионов водорода. [14]
В растворах с рН - 7 гальванические элементы, составленные из большинства металлов, будут работать без выделения газообразного водорода, так как потенциал разряда ионов водорода отрицательнее, чем потенциал анода. Только в растворах с рН 7 процесс коррозии может сопровождаться выделением водорода. Металлы с очень электроотрицательным потенциалом могут выделять водород из нейтральных и даже щелочных растворов. [15]
Страницы: 1 2 3