Потенциал - ртуть
Cтраница 1
 |
Схема полярографической установки с. [1] |
Потенциал ртути зависит только от концентрации ионов закисной ртути в растворе: концентрация Hg2 не изменяется, поэтому и потенциал ртути является постоянной величиной. Такой каломельный электрод служит в качестве электрода сравнения. [2]
Потенциал ртути зависит только от концентрации ионов закисной ртути в растворе: концентрация Hg, не изменяется, поэтому и потенциал ртути является постоянной величиной. Такой каломельный электрод служит в качестве электрода сравнения. [4]
 |
Схема полярографической установки. 1 - электролизер. 2 - ртутный капельный электрод. [5] |
Однако потенциал донной ртути изменяется при изменении состава р-ра, что вносит неопределенность в величину потенциала катода и исключает возможность сопоставления по-лярограмм одного и того же иона, полученных в разных условиях. Поэтому в настоящее время обычно пользуются стандартными электродами сравнения с достаточно большой площадью поперечного сечения ( ок. Электрод сравнения соединяют с катодным пространством соединительными ключами различной конструкции. [6]
 |
Схема аппаратуры Лип-пмана для измерения поверхностного натяжения.| Электрокапиллярная кривая. [7] |
При изменении потенциала ртути изменяется ее поверхностное натяжение. Изменяя высоту столба ртути в капилляре, можно удерживать мениск всегда в одном и том же положении. [8]
При дальнейшем смещении потенциала ртути в отрицательную сторону до величины е3 на ее поверхности появятся избыточные электроны, к которым со стороны раствора будут притягиваться положительно заряженные ионы. В этом случае снова возникнут отталкивательные силы между одноименно заряженными, но теперь уже отрицательными частицами, и поверхностное натяжение упадет до некоторой величины аа - По мере увеличения отрицательного значения потенциала будет увеличиваться избыточный отрицательный заряд ртути и одновременно уменьшится поверхностное натяжение. Восходящая ветвь электрокапиллярной кривой соответствует, таким образом, положительно заряженной поверхности ртути. Величина положительного заряда при этом по мере смещения потенциала в отрицательную сторону постепенно уменьшается, что увеличивает поверхностное натяжение. В точке максимума электрокапиллярной кривой заряд поверхности ртути равен нулю, а поверхностное натяжение достигает наибольшего значения. Нисходящая ветвь электрокапиллярной кривой отвечает отрицательно заряженной поверхности ртути. По мере удаления от точки максимума абсолютная величина заряда растет, а поверхностное натяжение уменьшается. Таким образом, представление об изменении заряда ртути с потенциалом ртутного электрода позволяет качественно объяснить ход электрокапиллярной кривой в растворах, не содержащих поверхностно-активных частиц. Если исходить из предположения о том, что адсорбция ионов на ртути определяется исключительно электростатическими силами, то все анионы должны были бы изменять ход лишь восходящей ветви электрокапиллярной кривой, где поверхность ртути заряжена положительно. Напротив, влияние катионов должно было локализоваться лишь на нисходящей ветви, где они электростатически притягиваются к отрицательно заряженной поверхности ртути. В действительности, как это было найдено еще Гун, многие анионы изменяют ход электрокапиллярной кривой справа от точки максимума, а некоторые катионы влияют не только на нисходящую, но и на восходящую ветви электрокапиллярной кривой. [9]
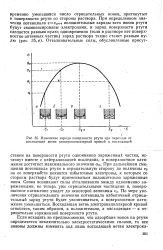 |
Изменение заряда поверхности ртути при переходе от восходящей ветви электрокапиллярной кривой к нисходящей. [10] |
При дальнейшем смещении потенциала ртути в отрицательную сторону до величины ез на ее поверхности появятся избыточные электроны, к которым со стороны раствора будут притягиваться положительно заряженные ионы. [11]
При работе с ртутным анодом потенциал ртути устанавливают по таллию. [12]
 |
Система для приложения потенциала к идеально поляризуемому. [13] |
Противоэлектрод здесь используется для поддержания потенциала ртути, который измеряется относительно хлор-серебряного электрода сравнения. [14]
 |
Система для приложения потенциала к идеально поляризуемому. [15] |
Страницы: 1 2 3 4
