Потенциал - ртуть
Cтраница 4
Отталкивательные силы, связанные с присутствием на поверхности ртути одноименно заряженных частиц, исчезнут вместе с нейтрализацией последних, и поверхностное натяжение достигнет некоторого значения ат. При дальнейшем смещении потенциала ртути в отрицательную сторону до величины s3 на ее поверхности появятся избыточные электроны, к которым со стороны раствора будут притягиваться положительно заряженные ионы. В этом случае снова возникнут отталкивательные силы между одноименно заряженными, но теперь уже отрицательными частицами, и поверхностное натяжение упадет до некоторой величины Стз. [46]
 |
Схема установки Липпман. для исследования зависимости поверхностного натяжения ртути от потенциала. [47] |
Объектом поляризации служил мениск ртути в капилляре ( рис. 1), а неполяризуемым электродом-ртуть на дне ячейки. Липпман установил, что при изменении потенциала ртути меняется ее поверхностное натяжение. При этом мениск ртути в капилляре опускается или поднимается, что можно наблюдать с помощью микроскопа. [48]
Величины Е / 2 отнесены к потенциалу донной ртути. На фоне буферных растворов Бриттона - Робинсона и растворов хлористого лития серпентин образует вольтамперные кривые, непригодные для аналитических целей вследствие наличия на них максимума. [49]
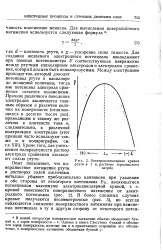 |
Электрокапиллярная кривая. [50] |
Для создания желаемого электродного потенциала накладывают при помощи потенциометра Е соответствующее напряжение между ртутным капиллярным электродом и электродом сравнения, который должен быть неполяризуемым. Между электродами проходит ток, который доводит потенциал ртути в капилляре до желаемой величины, тогда У как потенциал электрода сравнения остается неизменным. Причина различного поведения электродов заключается главным образом в различии величин их поверхности ( отличающихся в десятки тысяч раз), приводящем к такому же различию в плотности тока и, следовательно, к различной поляризации электродов ( этот принцип часто используют также и в полярографии, см. гл. [51]
Ртуть, как известно, практически не поляризуемый анод. Таким образом, для того чтобы сместить потенциал растворяющейся ртути до значения, при котором возможен nepexoAJ ее в раствор в виде ионов Hg, потребуется очень большая сила тока. Hg практически со всеми анионами, кроме NO -, образует малорастворимые соли. [52]
При проведении исследований в неводных растворителях прежде всего возникает проблема выбора электрода сравнения для измерения потенциала. Часто потенциалы на полярографической кривой относят к потенциалу ртути, находящейся в том же растворе; при этом ее потенциал, конечно, зависит от состава раствора. Кроме того, не исключается возможность поляризации такого электрода сравнения, причем степень поляризации зависит от природы растворителя и индифферентного электролита. Например, Влчек [2] нашел, что ртуть на дне ячейки в 17 М H2SO4 заметно поляризуется и, следовательно, не может служить электродом сравнения. Аналогичное явление в безводном ацетонитриле наблюдали Попов и Геске [3]; в качестве электрода сравнения при работе в ацетонитриле они рекомендуют применять хлорсеребряный электрод в растворе хлористого тетраметиламмония. Очень часто применяются выносные электроды сравнения, содержащие водные растворы, например насыщенный каломельный электрод, однако в этом случае в значение потенциалов полуволны входит величина диффузионного потенциала, определяемая ионами индифферентного электролита на границе раздела двух сред. При большой концентрации фона эта величина почти постоянна, что позволяет сравнивать между собой значения потенциалов полуволны различных деполяризаторов в данной среде. [53]
Определим направление протекания реакции а. Поскольку в данном случае более высоким является значение потенциала ртути, то ионы Hg2 ( образовавшиеся из [ HgBr4 ] 2 -) окисляют молекулы водорода и реакция а протекает справа налево. [54]
Период капания t определяют в процессе Измерения диффузионного тока и при том же потенциале капельного электрода, при котором определяют диффузионный ток. Удобно величину t определять в растворе ин-диферентного электролита при различных потенциалах капающей ртути ( см. электрокапиллярную кривую, стр. Следует записывать значения t при любых потенциалах, чтобы в бу дущем иметь возможность делать сравнение. [55]
Страницы: 1 2 3 4