Потенциал - нержавеющая сталь
Cтраница 1
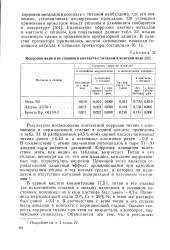 |
Коррозия меди и ее сплавов в контакте с титаном в морской воде. [1] |
Потенциал нержавеющей стали 20 % Сг 29 % Ni в этом же растворе был равен 0 4 в. [2]
Неустойчивость потенциала нержавеющих сталей в растворах хлоридов, которая наблюдается на кривых заряжения, можно объяснить - следующим образом. Адсорбированные ионы хлора вытесняют с поверхности кислород, что нарушает пассивное состояние сплава. Естественно, что активирование легче всего произойдет на тех участках, где кислород по тем или иным причинам менее прочно связан - с поверхностью металла. Потенциал этих активированных участков ста-нет более отрицательным по отношению к остальной запассивированной поверхности, что неизбежно вызовет работу активно-пассивных гальва-нических элементов и общий потенциал поверхности сместится в отри-дательную сторону. [3]
Неустойчивость потенциала нержавеющих сталей в растворах хлоридов, которая наблюдается на кривых заряжения, можно объяснить следующим образом. В одной из наших работ [22], выполненной при домощи радиоактивных индикаторов, было показано, что процесс активирования поверхности хлорид-ионами носит адсорбционный характер. Естественно, что активирование легче всего произойдет на тех участках, где кислород по тем или иным причинам менее прочно связан - с поверхностью металла. Потенциал этих активированных участков станет более отрицательным по отношению к остальной запассивированной поверхности, что неизбежно вызовет работу активно-пассивных гальванических элементов и общий потенциал поверхности сместится в отрицательную сторону. [4]
Акимов и Кларк [13] путем измерения потенциалов нержавеющих сталей в различных средах показали, что одновременная зачистка поверхности образцов в отсутствие доступа кислорода воздуха резко разблагораживает потенциалы последних. Это указывает на связь пассивности сталей с явлениями, происходящими на поверхности металла. [5]
В аэрированных средах, содержащих ионы хлорц онный потенциал нержавеющей стали может попасть t питтинговой коррозии. В этом случае положительный достигается при введении в сталь 2 - 3 % Мо: это повышаь тенциал питтингообразования фпо и коррозионный потенц. [6]
Механизм действия металлической меди был изучен Штрайхе [116], который определил потенциал нержавеющей стали типа 314, окислительно-восстановительный потенциал раствора ( при помощи платинированного платинового электрода) и потенциал меди. Измерения проводились с применением насыщенного каломельного электрода, однако результаты, которые приводятся ниже, даны по отношению к стандартному водородному электроду. В отсутствие металлической меди потенциал коррозии нержавеющей стали был 0 58 В, тогда как потенциал платинового электрода был приблизительно 0 77 В. Если в раствор вводят металлическую медь ( в отсутствие непосредственного контакта со сталью), то потенциал коррозии стали и потенциал платинового электрода приобретают значение 0 37 В, потенциал меди достигает значения 0 30 В. И наконец, если нержавеющая сталь находится в контакте с медью, она приобретает более отрицательный потенциал 0 3 В, потенциал меди при этом не меняется. Эти результаты были обработаны Штрайхе и представлены в виде диаграммы Ф - / ( рис. 10.17), показывающей как потенциал коррозии и ее скорость зависят от условий испытаний. [8]
 |
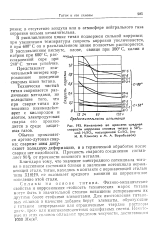
Изменение во времени средней. [9] |
Благодаря тому, что значение электродного потенциала титана и пассивном состоянии близко к значению потенциала нержавеющей стали, титан, находясь в контакте с нержавеющей сталью типа X18II9, не оказывает вредного влияния на коррозионное поведение этой стали. [10]
 |
Изменение во времени средней. [11] |
Благодаря тому, что значение электродного потенциала титана в пассивном состоянии близко к значению потенциала нержавеющей стали, титан, находясь в контакте с нержавеющей сталью типа Х18Н9, не оказывает вредного влияния на коррозионное поведение этой стали. [12]
Исходя из адсорбционной теории пассивности, представляется возможным объяснить и установленные нами закономерности. Потенциал нержавеющей стали ( 1Х18Н9Т) в хлористом аммонии ( 0 5 %), как это видно из рис. 171, имеет более отрицательные значения, чем критический потенциал питтингообразования, и поэтому вероятность появления пит-тинговой коррозии равна нулю. С введением в электролит окислителя и увеличением его концентрации потенциал стали все более смещается в положительную сторону ( рис. 171, кривая /), что облегчает, с одной стороны, адсорбцию отрицательно заряженных ионов хлора и, с другой стороны, делает их более активными. Начиная с определенной концентрации окислителя, потенциал стали перестает смещаться в положительную сторону, что не должно увеличивать адсорбцию хлор-ионов, а стало быть, и число зарождающихся питтингов. [13]
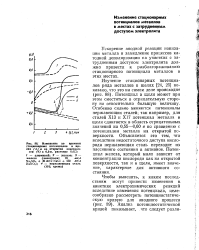 |
Изменение во времени стационарных потенциалов в щелях ( а и на открытой поверхности ( б в 0 5 - н. растворе NaCI. [14] |
Потенциал в щели может при этом сместиться в отрицательную сторону на относительно большую величину. Особенно сильно меняются потенциалы нержавеющих сталей; так например, для сталей Х13 и Х17 потенциал металла в щели сдвигается в область отрицательных значений на 0 55 - 0 60 в по сравнению с потенциалом металла на открытой поверхности. Объясняется это тем, что вследствие недостаточного доступа кислорода нержавеющая сталь переходит из пассивного состояния в активное. Потенциал железа, который мало зависит от концентрации кислорода как на открытой поверхности, так и в щели, имеет значение, характерное для активного состояния. [15]
Страницы: 1 2
