Потенциал - нержавеющая сталь
Cтраница 2
По этому методу нержавеющая сталь поляризуется анодно от внешнего источника тока и измеряется ее потенциал. По мере увеличения приложенного извне напряжения потенциал нержавеющей стали все более и более облагораживается. Допускается, что в этот момент происходит разрушение защитной пленки в одной или нескольких точках поверхности и это вызывает падение потенциала стали. Максимальное значение электродного потенциала, с которого начинается падение потенциала ( рис. 136), носит название потенциала пробоя и характеризует, по мнению многих авторов, устойчивость нержавеющих сталей по отношению к питтингу или склонность к питтингообразованию. [16]
 |
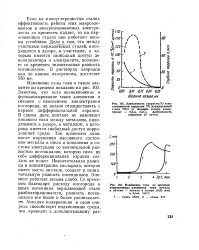
Влияние концентрации ванадата на скорость коррозии стали 1Х18Н9Т в растворах HN03 при 100 С.| Влияние температуры на скорость коррозии стали 1Х18Н9Т в растворах HN03, содержащей 1 % VOj. [17] |
При начавшемся коррозионном процессе по границам зерен кристаллитов продукты коррозии нержавеющей стали и продукты восстановления HN03, являясь эффективными катодными деполяризаторами, будут значительно стимулировать этот процесс. Введение ванадата в растворы HN03 повышает их окислительные свойства и приводит к сдвигу потенциала нержавеющей стали в область высоких положительных значений, достаточных для протекания коррозионного процесса из состояния перепассивации. С увеличением концентрации кислоты, добавки к ней ванадата и повышением температуры растворов этот сдвиг потенциала увеличивается. Особенно сильное смещение потенциала стали в положительную область происходит в концентрированных ( более 30 %) растворах кислоты при повышенных температурах. [18]
 |
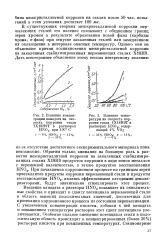
Электрохимическая защита стали X1SH10T от питтинговой коррозии в растворе 0 1 - н. NaCl 0 01 - н. НС1. [19] |
Благодаря тому, что существует критический потенциал, выше которого питтинговая коррозия не возникает, оказывается возможным осуществить электрохимическую защиту. Опыты в изученных нами электролитах показали, что катодная поляризация надежно защищает нержавеющую сталь от питтинговой коррозии. Достаточно сместить потенциал нержавеющей стали в отрицательную сторону за критическую величину [ ( 0 15) ч - ( - 0 20 в) ], чтобы питтинговой коррозии не было. [20]
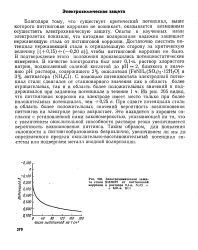 |
Электрохимическая защита стали Х18Н10Т от питтинговой коррозии в растворе 0 1 - н. NaCl 0 01 - н. НС1. [21] |
Благодаря тому, что существует критический потенциал, выше которого питтинговая коррозия не возникает, оказывается возможным осуществить электрохимическую защиту. Опыты в изученных нами электролитах показали, что катодная поляризация надежно защищает нержавеющую сталь от питтинговой коррозии. Достаточно сместить потенциал нержавеющей стали в отрицательную сторону за критическую величину [ ( 0 15) - f - ( - - 0 20 в) ], чтобы питтинговой коррозии не было. [22]
На практике благородные металлы ведут себя в соответствии со своим положением в ряду ЭДС. В) в морской воде более отрицателен, чем у высоконикелевых сплавов ( например, хастелоя) и нержавеющих сталей при условии, что эти сплавы находятся в пассивном состоянии. В то же время потенциал нержавеющей стали в активном состоянии подобен потенциалу низколегированной стали. Это означает, что нержавеющая сталь, содержащая 18 % Сг и 8 % №, в пассивном состоянии вызывает коррозию меди и медных сплавов, а в активном состоянии может сама подвергаться коррозии. [24]
Благодаря высокой удельной прочности и превосходным противокоррозионным свойствам его широко применяют в авиационной технике. В настоящее время его используют также для изготовления оборудования химических производств. Металл легко пассивируется в аэрированных водных растворах, включая разбавленные кислоты и щелочи. Полупроводниковые свойства пассивирующей пленки обусловлены в основном наличием кислородных анионных вакансий и междоузельных ионов ТЛ3, которые выполняют функцию доноров электронов и обеспечивают оксиду проводимость / г-типа. Потенциал титана в морской воде близок к потенциалу нержавеющих сталей. Фладе-потенциал имеет довольно отрицательное значение ( EF - 0 05В) [2, 3], что указывает на устойчивую пассивность металла. Нарушение пассивности происходит только под действием крепких кислот и щелочей и сопровождается значительной коррозией. [25]
Заметим, что хотя возникновение и функционирование таких элементов и связано с изменением концентрации кислорода, их нельзя отождествлять с парами дифференциальной аэрации. В самом деле, вначале не возникает никакого тока между металлом, находящимся в зазоре, и металлом, к которому имеется свободный доступ коррозионной среды. Ток возникает лишь после нарушения пассивного состояния металла в щели и появления в системе электродов со значительной разностью потенциалов, которую сама по себе дифференциальная аэрация создать не может. Незначительная разница в концентрации кислорода, которая имеет место вначале, создает и незначительную разность потенциалов. Элемент работает весьма слабо. Со временем благодаря расходу кислорода в щели потенциал нержавеющей стали разблагораживается, разность потенциалов все более и более увеличивается. [27]
Страницы: 1 2