Потенциал - электрод - второе - род
Cтраница 1
Потенциал электрода второго рода определяется уравнением Нернста только в том случае, если не наблюдается комплексообразования и дополнительного растворения соли. Однако, в апротонных растворителях вследствие меньшей сольватации ионов прочность комплексов обычно увеличивается. Поэтому вопрос о применимости того или иного электрода второго рода требует специальных исследований. Из-за комплексообразования предел применимости электрода второго рода в органических растворителях нередко ограничен по концентрации аниона. В связи с этим представляют интерес исследования растворимости и комплексообразования солей, используемых в электродах сравнения и в качестве положительных электродов в источниках тока. [1]
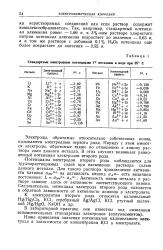 |
Стандартные электродные потенциалы V0 металлов в воде при 25 С. [2] |
Потенциалы электродов второго рода наблюдаются для труднорастворимых солей при насыщении раствора солью данного металла. Активность ионов металла в растворе зависит здесь от активности соответствующего аниона. Следовательно, потенциал электрода второго рода находится в обратной зависимости от активности анионов в электролите. [3]
Потенциалы электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, ртутно-сульфатные, хлорсеребряиые, ртутнооксидные и сурьмяные электроды. [4]
Потенциал электрода второго рода должен уменьшаться с увеличением концентрации хорошо растворимого электролита в растворе. [5]
Потенциалы электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, ртутно-сульфатные, хлорсеребряные, ртутнооксидные и сурьмяные электроды. [6]
Потенциал электрода второго рода с повышением активности аниона становится менее положительным. [7]
 |
Каломелевый электрод. [8] |
Потенциалы электродов второго рода определяются активностью анионов труднорастворимого соединения электродного металла. [9]
Потенциал электрода второго рода должен уменьшаться с увеличением концентрации хорошо растворимой соли в растворе. [10]
Следовательно, потенциал электродов второго рода зависит от активности анионов малорастворимого электролита и от числа у ионов металла в формульной единице этого электролита. [11]
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. [12]
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее интересны в практическом отношении каломельные, ртутно-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные электроды. [13]
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее интересны в практическом отношении каломельные, ртут-но-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные электроды. [14]
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. [15]
Страницы: 1 2 3