Потенциал - электрод - второе - род
Cтраница 3
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. [31]
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее интересны в практическом отношении каломельные, ртутно-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные электроды. [32]
Таким образом, потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее интересны в практическом отношении каломельные, ртут-но-сульфатные, хлор-серебряные, ртутно-окисные и сурьмяные электроды. [33]
Как видно, потенциал хлорсеребряного электрода определяется активностью иона хлора в растворе. Вообще говоря, потенциал электрода второго рода зависит от активности аниона малорастворимого соединения, входящего в состав электрода. [34]
Последнее свойство является общим для всех электродов второго рода. Из уравнения ( 19а) также видно, что потенциал электрода второго рода зависит от концентрации хорошо растворимого электролита. [35]
Последнее свойство - общее для всех электродов второго рода. Из уравнения ( 16) также видно, что потенциал электрода второго рода зависит от концентрации хорошо растворимой соли. [36]
Сравнивая потенциалы соответствующих электродов первого и второго рода, находят произведение растворимости труднорастворимых солей. Уравнение ( VI 1 - 37), в котором потенциал электрода второго рода представлен как функция активности металлических ионов, практически менее удобно, чем уравнение ( VII-34), так как активности металлических ионов ничтожно малы и являются производными от активностей соответствующих анионов. [37]
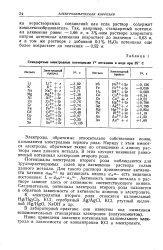 |
Стандартные электродные потенциалы V0 металлов в воде при 25 С. [38] |
Потенциалы электродов второго рода наблюдаются для труднорастворимых солей при насыщении раствора солью данного металла. Активность ионов металла в растворе зависит здесь от активности соответствующего аниона. Следовательно, потенциал электрода второго рода находится в обратной зависимости от активности анионов в электролите. [39]
К этому случайно вполне подходит формула оценки влияния ошибки в рН на lg KJJ. Естественно, что литературные данные по обсуждаемой константе, измеренные при низких концентрациях сульфидов, отличаются большим разбросом. В работе [7] без снижения точности намерений удалось обойтись гораздо более низкими концентрациями, применяя регистрацию изменений потенциала электрода второго рода - сульфидсеребряного, попутно тщательно изучив и доказав его обратимость к сульфид-ионам. [40]
В уравнении ( 19a): tAgci Ag 0 058 IgOPAgci является характерной величиной для данного полуэлемента, и ее можно рассматривать, как нормальный потенциал электрода второго рода. Таким образом, рассматриваемый электрод является одновременно обратимым как по отношению к катиону Ag, так и по отношению к аниону Ch. Последнее свойство является общим для всех электродов второго рода. Из уравнения ( 19а) также видно, что скачок потенциала электрода второго рода зависит от концентрации хорошо растворимого электролита. [41]
Страницы: 1 2 3