Потенциал - окислительно-восстановительный электрод
Cтраница 1
Потенциал окислительно-восстановительных электродов служит мерой окислительной или восстановительной способности систем. [1]
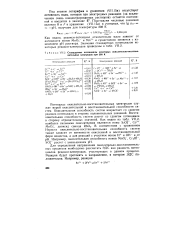 |
Стандартные потенциалы некоторых окислительно-восстановительных электродов при 298 К. [2] |
Потенциал окислительно-восстановительных электродов служит мерой окислительной и восстановительной способности систем. Окислительная способность систем возрастает со сдвигом редокси-потенциала в сторону положительных значений. Восстановительная способность систем растет со сдвигом потенциала в сторону отрицательных значений. Как видно из табл. VII.2, наиболее сильными окислителями являются ионы S2Oi -, Co3, МпОг, диоксид свинца RbOz. [3]
 |
Схема окислительно-восстацовительдой цепи. [4] |
Потенциал окислительно-восстановительного электрода зависит от соотношения концентраций окисленной и восстановленной форм в растворе. Окисленная форма способна присоединять электроны, переходя при этом в восстановленную форму. Поэтому чем больше концентрация окисленной формы, тем сильнее выражена способность электрода к присоединению электронов. Восстановленная форма способна терять электроны, переходя при этом в окисленную форму. [5]
Потенциал окислительно-восстановительных электродов служит мерой окислительной и восстановительной способности систем. Окислительная способность систем возрастает со сдвигом редокси-потенциала в сторону положительных значений. Восстановительная способность систем растет со сдвигом потенциала в сторону отрицательных значений. [6]
Зависимость потенциала окислительно-восстановительного электрода от рН не означает, что его можно уподобить газообразному водородному электроду. [7]
Итак, потенциалы окислительно-восстановительных электродов определяются природой редокси-процессов и температурой и зависят от соотношения активностей окисленной и восстановленной форм вещества, а для реакций с участием ионов Н или OFT также от рН раствора. [8]
Большая величина потенциала окислительно-восстановительного электрода указывает на то, что на этом электроде может интенсивно протекать процесс присоединения электронов. Малая величина потенциала ( когда он выражается отрицательными числами) говорит о том, что на данном электроде может интенсивно идти процесс отдачи электронов. Таким образом, величина окислительно-восстановительного потенциала служит мерой интенсивности процессов окисления - восстановления, которые могут протекать в данном растворе. [9]
Из расчетного уравнения видно, что потенциал окислительно-восстановительного электрода зависит от активности ионов Н в растворе. [10]
Значение Е определяется по отношению к стандартному водородному электроду и равно потенциалу окислительно-восстановительного электрода при активностях окисленной и восстановленной форм, равных единице. Чем больше стандартный окислительно-восстановительный потенциал, тем выше активность окислителя в этой системе и тем в большей степени выражены ее окислительные свойства. [11]
Вследствие инертности комплексов Со ( III) их равновесие с раствором при обычных температурах достигается очень медленно. Это и обусловливает зависимость потенциала окислительно-восстановительного электрода от времени, если состав исходных комплексов Со ( III) отличается от состава, отвечающего условиям равновесия. Подобного рода зависимости изучаются в растворах, насыщенных инертным газом, что исключает осложняющее влияние на электродный потенциал реакции окисления восстановленной формы молекулярным кислородом, либо процесса электровосстановления последнего. [12]
Ре ( RT / zF) nKa называется нормальным окислительно-восстановительным потенциалом. Его величина определяется по отношению к стандартному водородному электроду и равна потенциалу окислительно-восстановительного электрода, когда аре аре 1, а для разбавленных растворов сре. [13]
Необходимо подчеркнуть, что такой переход реакции от необратимой к обратимой является следствием того механизма, который мы приняли для нее в области кислых растворов. В более щелочных растворах ход поляризационной кривой определяется уже закономерностями концентрационной поляризации. В частности, при увеличении рН раствора потенциал восстановления должен меняться по такой же зависимости, как и потенциал равновесного окислительно-восстановительного электрода системы кислород - перекись водорода. [14]
В настоящее время для измерения рН чаще всего применяют стеклянный электрод с водородной функцией, изобретенный в 1909 году Габером и Клемен-севичем. Электрод ( мембрану) погружают в раствор, рН которого измеряют. Внутри трубки находится раствор постоянного состава, в который погружена серебряная проволока покрытая хлоридом серебра. По механизму действия стеклянный электрод отличается от ранее рассмотренных, так как за его потенциал ответственна не окислительно-восстановительная реакция, а разность потенциалов на границе раздела фаз раствор - стеклянная мембрана. В контакте с водным раствором поверхностный слой стеклянной мембраны подвергается гидратации, происходят процессы ионного обмена между стеклом и раствором, а ионы водорода диффундируют внутрь гидратирован-ного ( гелеобразного) слоя стекла. Благодаря этим явлениям устанавливается разность потенциалов между электродом и раствором, величина которой так же зависит от рН, как потенциалы ранее рассмотренных окислительно-восстановительных электродов. Стеклянный электрод для измерения рН является примером мембранных электродов. [15]
Страницы: 1