Потенциал - амальгамный электрод
Cтраница 1
Потенциал амальгамного электрода, следовательно, совершенно так же изменяется с изменением активности ионов Na в растворе, как и потенциал обычного ( нернстовского) металлического электрода, но в отличие от последнего он зависит еще и от концентрации металла в амальгаме, становясь более отрицательным ( понижаясь) с увеличением концентрации амальгамы. [1]
Потенциал амальгамного электрода зависит от концентрации металла в амальгаме и от концентрации его ионов в электролите. [2]
Поскольку потенциал амальгамного электрода зависит от концентрации металла в амальгаме, при измерениях с амальгамными электродами нельзя пользоваться табличными значениями стандартных потенциалов. Величину Е обычно определяют экспериментально. [3]
Зависимость потенциала амальгамного электрода от силы внешнего тока выражается уравнением Я. [4]
Кроме того, потенциалы амальгамных электродов не всегда соответствуют нормальным электродным потенциалам металлов, образующих амальгамы. [5]
Отсюда следует, что потенциал амальгамного электрода зависит от активности катиона в растворе, а также от активности компонента в металлической фазе. [6]
Отсюда следует, что потенциал амальгамного электрода зависит от активности катиона в растворе и активности компонента в металлической фазе. [7]
Из уравнения (1.1) следует, что потенциал амальгамного электрода определяется не только активностью потенциало-определяющих ионов в растворе, но он также зависит, как это было впервые показано Тюриным [98-100], и от логарифма активности щелочного металла в амальгаме. [8]
Особая методика измерений, описываемая далее, позволяет в значительной степени исключить влияние растворения амальгамы на потенциал амальгамных электродов, если концентрация ионов в растворах не очень мала. [9]
При выводе кинетических уравнений было принято, что в каждый момент времени потенциал амальгамы может быть определен по уравнению для потенциала равновесного амальгамного электрода и что скорость процесса разложения амальгамы лимитируется скоростью восстановления органических соединений. [10]
Значительное отличие стандартного потенциала ( расчет в [38] по данным [91]) ( табл. 1.1), скорее всего, обусловлено неполной растворимостью цинка в ртути при исследовании потенциала амальгамного электрода в работе [91], особенно вблизи точки насыщения. [11]
В литературе имеется большой исходный материал по электрохимической и термодинамической характеристике гальванических цепей (1.110) - (1.112), но только в работе [38] этот материал был в полной мере использован для нахождения стандартных ОВ потенциалов амальгамных электродов. [12]
Таким образом, ртуть в потенциалопределяющей реакции не участвует. Потенциал амальгамного электрода зависит только от активности ионов соответствующего металла в растворе и от активности его в амальгаме. По достижении амальгамой насыщенного состояния потенциал ее уже не зависит от дальнейшего увеличения концентрации металла. [13]
Для создания электрического контакта используется платиновая проволока. Вообще потенциалы амальгамных электродов более воспроизводимы, чем потенциалы твердых металлических электродов, которые чувствительны к поверхностным примесям и механическим деформациям в кристаллическом твердом теле. [14]
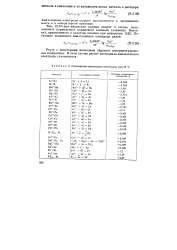 |
Стандартные электродные потенциалы при 25 С. [15] |
Страницы: 1 2