Потенциал - амальгамный электрод
Cтраница 2
Ртуть с некоторыми металлами образует интерметаллические соединения. В этом случае расчет потенциала амальгамного электрода усложняется. [16]
Описанная методика была использована для изучения механизма процесса ионизации цинка из амальгамы цинка ( 0 005 - 0 6 ат. Поэтому для заметного смещения потенциала амальгамного электрода от равновесного потенциала приходится поляризовать электрод большими токами, при которых может наступать концентрационная поляризация и может нарушаться равномерное распределение радиоактивных частиц внутри обеих фаз; тем самым могут искажаться результаты радиохимических измерений. [17]
Уравнение (1.1) применимо в широком интервале концентраций амальгам, однако в работах Эрдей-Груц показано [102-104], что при концентрациях металла в амальгаме, меньших, чем 10 - 5 - 10-а г-аг / л, потенциал амальгамы уже не может быть описан этим уравнением. При таких низких концентрациях величина потенциала амальгамных электродов часто определяется адсорбцией ионов. В работах [160, 161], для ряда амальгам рассмотрены условия применимости уравнения (1.1) в области низких концентраций. [18]
Поскольку и комплексообразователь, и щелочной металл играют решающую роль в процессе выделения РЗЭ на ртутном электроде, отношение между концентрациями всех трех веществ должно иметь большое значение. Интересно, что благодаря присутствию щелочного металла в амальгаме и в растворе, потенциал амальгамного электрода оказывается практически равновесным и не изменяется во время электролиза сколько-нибудь существенно при изменении концентрации РЗЭ в растворе или в амальгаме, так как потенциал определяющим фактором является не лантанид, а щелочной металл. [19]
Многие металлы ( Си, Ag, Аи, Cd, Zn и др.) растворяются в ртути. В амальгаме активность растворенного металла уже не равна единице, в связи с чем потенциал амальгамного электрода зависит от активности металла и его катионов. [20]
 |
Поляризационная диаграмма полиметаллической амальгамы в 0 1 н. растворе НС1О4 ( анодная кривая. [21] |
Таким образом, ртуть в потенциалопределяющей реакции не участвует. Она является как бы инертной средой. Потенциал амальгамного электрода зависит только от активности ионов соответствующего металла в растворе и от активности его в амальгаме. По достижении амальгамой насыщенного состояния потенциал ее уже не зависит от дальнейшего увеличения концентрации металла. [22]
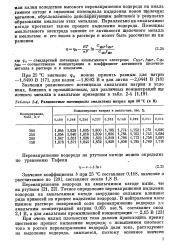 |
Равновесные потенциалы амальгамы аатрия при 80 С ( в В. [23] |
Параллельно на амальгамной катоде протекает также процесс выделения водорода. Потенциал амальгамного электрода зависит от активности щелочного металл. [24]
Страницы: 1 2