Потенциал - хлорный электрод
Cтраница 1
Потенциал хлорного электрода определяется активностью анионов. В отличие от электродов, обратимых относительно катиона, его потенциал с ростом концентрации потенциалопреде-ляющих ионов понижается. [1]
Потенциал хлорного электрода устанавливается довольно медленно, особенно в тех случаях, когда подкладкой служат угольные стержни со значительной зольностью. Предварительная даже кратковременная анодная поляризация электродов в хлоридных расплавах или обработка их в атмосфере хлора при высокой температуре значительно сокращает время достижения равновесных значений потенциала. [2]
Потенциал хлорного электрода определяется активностью анионов. В отличие от электродов, обратимых относительно катиона, его потенциал с ростом концентрации потенциалопреде-ляющих ионов понижается. [3]
При потенциале обратимого хлорного электрода возможен разряд кислорода, что приводит к износу графита в результате электрохимического окисления параллельно с химическим окислением графита вследствие взаимодействия его с активным хлором, находящимся в растворе. [5]
 |
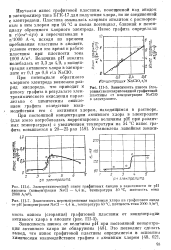
Хлорный электрод сравнения, применяемый в высокотемпературной электрохимии. [6] |
Однако в отличие от металлических электродов потенциал хлорного электрода возвращается к равновесной величине, как только прекращается их доступ. [7]
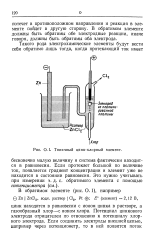 |
Типичный цинк-хлорный элемент. [8] |
Потенциал цинкового электрода отрицателен по отношению к потенциалу хлорного электрода. [9]
Для перехода к хлорной шкале потенциалов в конце таблицы приведен потенциал хлорного электрода. [10]
Можно положить условно для всех чисто хлоридных расплавов активность ионов хлора равной единице и считать потенциал хлорного электрода при Pci2 l атм равным нулю. [11]
С) затрудняет подбор достаточно устойчивого материала электрода, не реагирующего с хлором. Это также является одной из причин отклонения экспериментального значения потенциала хлорного электрода от обратимой величины потенциала, определяемой на основании термохимических данных. [12]
 |
Поправки к потенциалу Ае хлорного электрода, мВ.| Хлорный электрод. [13] |
Хлорный электрод сравнения, равновесный потенциал которого в хлоридном расплаве определяется полуреакцией (4.26), принято считать стандартным. Основным условием стандартности является ра, 1 013 - 105 Па, при этом потенциал хлорного электрода принимают равным нулю. [14]
Пластина омывалась хлорным анолитом с растворенным в нем хлором при 94 С и имела потенциал, близкий к потенциалу обратимого хлорного электрода. [15]
Страницы: 1 2