Потенциал - железный электрод
Cтраница 1
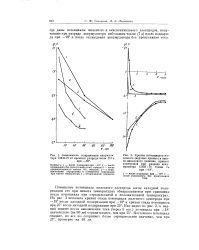
Потенциалы железных электродов, покрытых медью ( рис. 47, а), как и предсказывалось, сильно зависят от толщины покрытия, что указывает на эффективную работу биметаллической системы. Чем тоньше слой медного покрытия, тем ближе потенциал электрода к потенциалу железа, откуда следует, что анодное растворение железа в порах протекает без заметной поляризации. При малых толщинах медного покрытия ( 1, 5 и 10 мкм) потенциал во времени разблагора-живается, что указывает на ускорение процесса анодного растворения железа в порах. С утолщением слоя меди потенциал электрода приближается к потенциалу меди и практически совпадает с ним при толщине слоя 40 - 50 мкм. Начиная с 20 мкм наблюдается уже облагораживание потенциала во времени, что свидетельствует об увеличении анодной поляризации металла в порах. [1]
Потенциалы железных электродов, покрытых медью ( рис. 47 а), как и предсказывалось, сильно зависят от толщины покрытия, что указывает на эффективную работу биметаллической системы. [2]
Повышение потенциала железного электрода после катодной поляризации его при низких температурах обнаруживается при сравнении спада потенциала при отрицательной и положительной температурах. Как видно из рис. 3, в первый момент после выключения тока ( через 5 сек. Постепенно потенциал спадает, но все же сохраняет более отрицательное значение, чем при 25, примерно на 40 мв. [4]
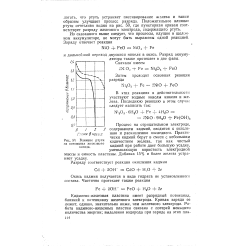 |
Влияние ртути. [5] |
Кадмиево-железная пластина имеет разрядный потенциал, близкий к потенциалу железного электрода. Кривая заряда ее лежит, однако, значительно ниже, чем железного электрода. [6]
Так, например, согласно данным Л. В. Ванюковой и Б. Н. Кабанова [5], потенциал пассивного железного электрода при анодной поляризации в растворах щелочей изменяется непрерывно, концентрация кислорода на поверхности меняется постепенно, а не в стехеометрическом соотношении с железом. [7]
Электролит для лужения жести в начале процесса не содержит железа, поэтому потенциал железного электрода электроотрицательнее оловянного. [8]
В то же время на основании измерения электродных потенциалов железа в моносульфидных и полисульфидных растворах предполагают [93], что потенциал железного электрода не является функцией обратимого железо-сульфидного электрода типа Fe FeSHac S даже в концентрированных и моносульфидных растворах. По-видимому, наиболее обосновано мнение [91] о том, что корродирующее в растворе сероводорода железо можно рассматривать как катоднополяризованный водородный электрод с его собственными константами водородного перенапряжения. [9]
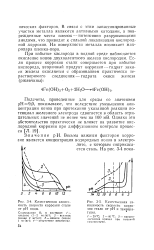 |
Качественная зависимость скорости коррозии стали от рН воды.| Качественная зависимость скорости коррозии стали от рН и температуры. [10] |
Подсчеты, проведенные для среды со значением рН - 9 0, показывают, что вследствие уменьшения концентрации ионов при протекании указанной реакции потенциал железного электрода сдвигается в область отрицательных значений не менее чем на 100 м В. [11]
Тот взгляд, что защита свинцовым суриком главным образом химическая благодаря способности его сохранять железо пассивным, в то время как защита окисью железа - механическая, подтвержден недавними измерениями Бернса и Хе-ринга 2 потенциалов железных электродов, покрытых указанными двумя соединениями. [12]
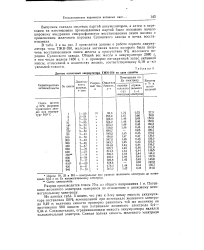 |
Данные испытаний аккумулятора ТЖН-350 на срок службы. [13] |
Из данных табл. 3 видно, что уже к 3-му циклу емкость аккумулятора составляла 150 % номинальной при потенциале железного электро-да 0 49 0; величина емкости примерно равнялась той же величине на протяжении 900 циклов при потенциале железного электрода 0 4 - 0 44 в. [14]
Активные железные массы, полученные восстановлением окиси железа в присутствии железных порошков или окалины, содержащей избыточную закись железа, и испытанные на срок службы в течение 950 циклов в аккумуляторах ТЖН-350, показали высокую отдачу по емкости ( до 150 % ( номинальной) при потенциале железного электрода в пределах 0 44 - 0 46 в по Zn вспомогательному электроду. [15]
Страницы: 1 2