Потенциал - железный электрод
Cтраница 2
С потенциал железного электрода в растворе собственных ионов при отсутствии внешней поля-ризации является равновесным: величина его изменяется с концентрацией ионов железа в соответствии с уравнением Нернста и в противополси-ность низким температурам не зависит от рН раствора, анионного состава и присутствия кислорода. Обратимость железного электрода при высоких температурах авторы связывают с устранением чужеродных частиц, активацией поверхности электрода и устранением аномалии железа, обусловленной адсорбционно-химическим взаимодействием поверхности электрода с компонентами раствора. [16]
Сдвиг потенциала металла в положительную сторону при движении В. А. Кистяковский называет мотохимическим явлением. Так, измеренный им потенциал неподвижного железного электрода оказался равным - 0 46 - 0 50 в, а движущегося электрода - 0 21 - 0 24 в. [17]
Коррозия железа возможна, пока потенциал железного электрода ниже кислородного. [18]
При снижении плотности тока перенапряжение для выделения водорода падает резче, чем для выделения железа, поэтому уменьшается и выход железа по току. Применять при заряде очень большие плотности тока нельзя, так как у поверхности электрода раствор локально обеднеет ионами HFeOsT - Потенциал железного электрода в щелочи на 45 мв отрицательней потенциала водородного электрода в том же растворе. Это является причиной непрерывного самопроизвольного растворения железного электрода в электролите. [19]
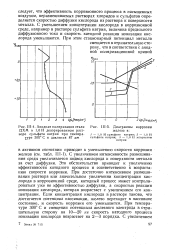 |
Анодная поляризация стали 12ХМ в 1ОН деаэрированном растворе сульфата натрия при температуре 300 С и давления 87 am.| Диаграммы коррозии железа в. [20] |
С увеличением интенсивности размешивания среды увеличивается подвод кислорода к поверхности металла за счет диффузии. Это обстоятельство приводит к увеличению эффективности катодного процесса и соответственно к возрастанию скорости коррозии. При достаточно интенсивном размешивании раствора или значительном увеличении концентрации кислорода в коррозионной среде, катодный процесс может контролироваться уже не эффективностью диффузии, а скоростью реакции ионизации кислорода, которая возрастает с увеличением его концентрации. Если концентрация кислорода в растворе такова, что достигается потенциал пассивации, железо переходит в пассивное состояние, и скорость коррозии его уменьшается. При температуре 300 С и смещении потенциала железного электрода в отрицательную сторону на 10 - 20 же скорость катодного процесса ионизации кислорода возрастает на 2 - 3 порядка. [21]
Учитывая, что молибдаты и вольфраматы имеют химическую структуру, сходную с хроматами, можно было считать, что их ингибирующее влияние также окажется аналогичным действию хроматов. Они действительно являются хорошими ингибиторами коррозии, однако при одинаковых концентрациях не столь эффективными, как хроматы. Высокая стоимость этих соединений по сравнению с хроматами исключает возможность их практического применения. Прайор и Коэн [76] показали, что в отличие от хроматов эффективность мо-либдатов и вольфраматов проявляется только в присутствии кислорода. В работе Симпсона и Картледжа [113] было исследовано влияние кислорода на потенциалы растворов молибдатов, вольфраматов, хроматов и пертехнетатов. Они установили, что в присутствии растворенного воздуха все четыре раствора поддерживают потенциал железного электрода при значениях, лежащих положительнее потенциала Фладе. В деаэрированных растворах молибдатов и вольфраматов потенциал железа имеет такое же значение, как и в растворах сульфата натрия. В деаэрированных растворах хроматов потенциал более положителен, чем в растворах молибдатов и вольфраматов, и менее положителен, чем в растворах пертехнетатов. Работа, проведенная Брегманом по изучению поведения молибдатов и вольфраматов на лабораторных моделях систем башенного охлаждения, показала, что эти соединения обладают ингибирующими свойствами, однако их эффективность оказалась ниже эффективности хроматов и полифосфатов. Интерес к этим соединениям возник в связи с тем, что они значительно менее токсичны, чем хроматы, и могут заменить последние в тех случаях, когда применение их запрещается законами по охране водоемов от загрязнения. [22]
Страницы: 1 2