Потенциал - электролиз
Cтраница 1
Потенциал электролиза в интервале - 0 5 - 0 в не влияет на величину максимального тока восстановления соединения, образующегося на электроде. [2]
Потенциал электролиза в значительной мере определяет выбор растворителя, который должен выдерживать анодное напряжение не менее 2 В. Этому требованию из обычных растворителей удовлетворяют сульфолан, уксусный ангидрид, СН2С12, MeNO2, MeCN. [3]
Смещение потенциала электролиза в отрицательную сторону, если он соответствует предельному току, не влияет на характер поляризационных кривых. Это обусловлено, вероятно, торможением катодного процесса при изменении знака заряда поверхности электрода. В других случаях этот эффект не обнаружен. При потенциале предельного тока диффузии и равномерном перемешивании раствора или использовании вращающегося дискового электрода количество образующегося на электроде осадка пропорционально концентрации участвующих в процессе ионов и продолжительности электролиза. [4]
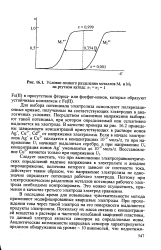 |
Условие полного разделения металлов MI и М2 на ртутном катоде. п п2 1. [5] |
Для выбора потенциала электролиза используют поляризационные кривые, полученные на соответствующих электродах в аналогичных условиях. Посредством изменения напряжения выбирают такой потенциал, при котором определяемый ион селективно выделяется на электроде. В качестве примера на рис. 16.2 приведены зависимости концентраций присутствующих в растворе ионов Ag, Cu2, Cd2 от напряжения электролиза. [6]
Стадию успокоения раствора проводят либо при потенциале электролиза, либо при потенциале, близком к равновесному значению, с целью уменьшения тока восстановления или окисления фона и растворения примесей. [7]
Предварительное концентрирование определяемых элементов проводят в ртутном пленочном электроде при подобранных потенциалах электролиза. При полярографирова-нии на самописце полярографа регистрируются вольтампер-ные кривые с характерными пиками, положение которых по оси потенциалов характеризует природу иона, а высота пиков - его концентрацию. Численные значения потенциалов в тексте приведены по отношению к насыщенному каломельному электроду. [8]
Значительно удобнее для разделения элементов выделять их в виде металлов электролизом; изменяя потенциал электролиза и изменяя среду, из которой производится электролиз, можно последовательно разделять различные элементы ( стр. [9]
Полярографический, определение микроколичеств тяжелых металлов на приборах с графитовым электродом с золотым покрытием, потенциал электролиза 0 2 В для мышьяка. [10]
Установлено, что материал, форма и расположение электродов, полярность напряжения во многом определяют эффективность ячейки, в частности, ее энергопотребление и потенциал электролиза. Разработаны рекомендации по оптимизации конструкции ячейки для того, чтобы снизить падение напряжения на электродах с 4 до 2 В и далее в направлении достижения теоретического уровня - до 48 В. [12]
Следует иметь в виду, что в начале электролиза, когда цепь только что замкнута, потенциал рабочего электрода быстро меняется, доходя до потенциала электролиза. Такому изменению потенциала будет препятствовать расход тока на заряжение электрода; этот ток может в ряде случаев составлять заметную долю от полного тока в начальный момент электролиза. [13]
Полярографическое определение меди, висмута и сурьмы в кадмии высокой чистоты и его солях без отделения основы основано на предварительном концентрировании определяемых элементов в ртутном пленочном электроде при подобранных потенциалах электролиза. [14]
Основные факторы, определяющие силу анодного тока ( IA), следующие: концентрация ионов металла в растворе, радиус ртутной капли, объем раствора, время электролиза, потенциал электролиза, гидродинамические условия во время электролиза, скорость изменения потенциала во время съемки и некоторые другие. [15]
Страницы: 1 2 3