Потенциал - электролиз
Cтраница 2
В начальный момент времени, когда цепь электролиза только что замкнута и заданное напряжение прикладывается к рабочему электроду, потенциал этого электрода будет быстро меняться от величины, которую мы имеем при разомкнутой цепи, до потенциала электролиза. Этому изменению потенциала будет препятствовать емкость области раздела электрод-электролит, так что до установления электролиза через цепь должен протечь какой-то начальный ток заряжения. [16]
Каталитическое действие электродного материала на направление электрохимической реакции наиболее отчетливо проявляется на катодах с низким перенапряжением водорода, по иногда наблюдается и на электродах с его высоким перенапряжением. Относительное содержание этих продуктов зависит от потенциала электролиза н подготовки поверхности электродов. [17]
Потенциал рабочего электрода выбирают так, чтобы электрохимическая реакция протекала со 100 % - ным выходом по току и с наибольшей скоростью. Для этого снимается вольтамперная кривая для определяемого вещества на данном фоне, на основании которой выбирают потенциал электролиза, который должен находиться в области предельного диффузионного тока. [18]
Радикальным способом повышения отношения сигнал / шум в вольтамперометрии является электрохимическое концентрирование определяемого вещества. Для этих целей удобно выделять определяемый компонент на поверхности индикаторного электрода электролитически, подобрав соответствующее значение потенциала электролиза, а также с помощью окислительно-восстановительных реакций или в результате адсорбции. Полученный концентрат затем может быть подвергнут электрохимическому превращению. Поскольку содержание определяемого вещества в концентрате на несколько порядков выше по сравнению с раствором, величина аналитического сигнала резко возрастает. [19]
Случаи 1, 2 и 3 типичны для селективного и неселективного восстановления. Для молекул, поведение которых отвечает случаям 1 и 2, возможно образование частично восстановленных продуктов МН2 при контролируемых потенциалах электролиза. Если же молекулы ведут себя в соответствии со случаем 3, то частично восстановленные продукты таким путем не могут быть получены. [20]
Ионы железа восстанавливаются до металла на графитовом электроде из растворов, содержащих комплексные ионы элемента. Оптимальные потенциалы осаждения из 0 05 М раствора сульфоса-лицилата натрия ( рН 5) и раствора, 1 М по КОН и 0 001 М по тар-трату натрия, составляют - 1 6 и - 1 4 в. При увеличении концентрации гидроксильных ионов в растворе потенциал электролиза следует выбирать более отрицательным. Удобнее использовать в качестве фона раствор, 1 М по КОН и 0 01 М по тартрату натрия, так как в этом случае в процессе концентрирования железа не разряжаются ионы водорода и результаты анализа лучше воспроизводятся. [21]
Ячейку помещают в термостат и при температуре 50 и перемешивании анализируемого раствора азотом выдерживают не менее 5 минут. После чего при потенциале 0 6 в проводят электролиз. По окончании электролиза ток азота прекращают, потенциал электролиза снижают до величины, отрицательнее потенциала растворения на 30 мв [1, 2], и ячейку быстро переносят в другой термостат с температурой 20, выдерживают в нем 5 минут - после чего снимают анодную полярограмму. [22]
Фарадеевский ток определяется массопереносом, как это уже было показано при обсуждении электродных процессов. В ходе электролиза снижению концентрации реагирующего вещества у поверхности электрода могут препятствовать диффузия ( в сочетании с кинетикой электродных процессов), конвекция ( перемешивание раствора или вращение электрода) и миграция. Эти три основных механизма массопереноса влияют как на потенциал электролиза, так и на ток. Диффузионную и конвекционную компоненты обычно включают в математическое описание фарадеевского электродного процесса, и это такие явления, из которых следуют фундаментальные понятия полярографического анализа. Поэтому в большинстве описаний электродных процессов предполагается, что миграционный ток равен нулю или ничтожно мал, и при выполнении полярографического эксперимента важно знать, что это предположение выполняется. Чтобы это условие выполнялось, в полярографии обычно в раствор сознательно вводят инертный фоновый электролит. [23]
При выделении микропримесей следует учитывать факторы, зависящие от условий электролиза ( напряжение или потенциал, материал и рабочая поверхность электрода), природы и концентрации выделяемых микропримесей, продолжительности электролиза, свойств применяемого электролита ( состав, вязкость), а также температуры и перемешивания. Поскольку электровыделение примесей происходит из очень разбавленных растворов, важнейшими факторами его становятся скорость транспортировки компонентов к поверхности электрода и потенциал электрода. В случае избирательного концентрирования для последующего атомно-абсорбционного анализа потенциал электролиза определяется потенциалом разряда выделяемого компонента и в принципе условия концентрирования не отличаются от условий электролиза в инверсионных методах электроанализа. [24]
В основе метода амальгамной полярографии с накоплением на ртутной капле лежит получение полярограмм при анодном растворении металла из амальгамы, полученной электролизом. Электрическое осаждение вещества на ртутную каплю производится в течение строго определенного времени при постоянном потенциале. Затем ртутный катод подвергается анодной поляризации, при непрерывно меняющемся потенциале от потенциала электролиза до 0 в. Полученные на полярограмме кривые имеют форму пиков. Однако в случае получения амальгамы электролизом, металл осаждается в поверхностном слое ртутной капли и диффузия его в глубь капли происходит постепенно. [25]
Изучение процесса окисления диэтилдитиокарбамата натрия на графитовом электроде показало, что продукт электролиза концентрируется на электроде. Образующийся при этом осадок способен к дальнейшему окислению и восстановлению. Оба процесса описываются характерными кривыми с максимумом тока ( рис. 70), величина которого зависит от потенциала электролиза и прямо пропорциональна продолжительности осаждения и концентрации диэтилдитиокарбамата натрия в растворе. [26]
Определению мышьяка методом кулонометрии при заданном потенциале посвящен ряд работ [511, 512, 879, 880], в которых проведено широкое исследование окисления мышьяка ( Ш) до мышьяка ( У) на платиновых электродах в кислых растворах. Установлено, что этот процесс в 1 М H2S04 протекает со 100 % - ной эффективностью по току. Окисление мышьяка ( Ш) кислородом воздуха в условиях эксперимента практически не оказывает никакого влияния на результаты кулонометрического определения. Потенциал электролиза от - 1 0 до - 1 2 б обеспечивает полное протекание электродной реакции, при этом никаких промежуточных продуктов окисления зафиксировать автором не удалось. [27]
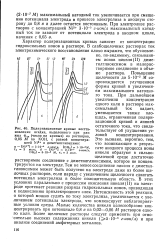 |
Поляризационные кривые восстановления осадка, выделенного при разных фэл ( числа на кривых из растворов, 0 05 М по КОН, с разной концентрацией Ni2 и диметилглиоксима. [28] |
Повышение щелочности до 5 - 10 - 2 М сопровождается улучшением формы кривой и увеличением максимального катодного тока. При дальнейшем увеличении концентрации едкого кали в растворе максимальный ток падает, уменьшается также площадь, ограниченная поляризационной кривой и линией остаточного тока, что свидетельствует об ухудшении условий концентрирования. Это вызвано, вероятно, тем, что возникающие в результате анодного процесса ионы никеля образуют в сильнощелочной среде достаточно растворимое соединение с диметилглиоксимом, которое не концентрируется на электроде. Тем не менее соединение никеля с диметилглиоксимом может быть получено на электроде даже из более щелочных растворов, если наряду с увеличением щелочности сдвигать потенциал электролиза в более положительную область. В этих условиях параллельно с процессом окисления никеля ( II) на электроде протекает реакция разряда гидроксильных ионов, приводящая к подкислению приэлектродного слоя. Интенсивность этой реакции, о которой можно судить по току электролиза, увеличивается с увеличением потенциала электрода, что компенсирует неблагоприятные условия среды. Малые количества никеля целесообразно концентрировать при потенциале 0 8 в из 0 02 - 0 06 М растворов едкого кали. Более щелочные растворы следует применять при относительно высоких содержаниях никеля ( 5 - 10 - 6 г-ион / л) и при анализе соединений амфотерных металлов. [29]
В подавляющем большинстве случаев электролиз с контролируемым потенциалом проводится с использованием ртутного или платинового рабочего электрода. Высокое перенапряжение водорода на ртути является важным преимуществом при использовании ее в качестве катода, однако анодное растворение ртути ограничивает ее применение в качестве электрода в анодной области для кулонометрии точно так же, как и для полярографии. Ртутные катоды, кроме того, обладают такими полезными характеристиками, как легко определяемая истинная площадь, обновляющаяся поверхность и относительная легкость очистки. Однако здесь необходима известная осторожность: многие процессы, которые кажутся простыми на микроэлектродах ввиду пренебрежимо малого накопления продуктов электролиза, оказываются го - раздо более сложными, когда проводятся на больших ртутных катодах. Следует также иметь в виду, что сама ртуть может действовать как химический восстановитель; следовательно, легко восстанавливаемые вещества должны приводиться в контакт с ртутными катодами только в том случае, когда к ячейке приложен нужный потенциал электролиза для предупреждения возможности предварительного химического восстановления. [30]
Страницы: 1 2 3