Изобарный потенциал
Cтраница 3
Поскольку изобарный потенциал является экстенсивным и аддитивным свойством системы, то естественно, что его значение может быть получено с помощью конкретных величин изобарных потенциалов, имеющихся для других реакций. [31]
Поскольку изобарный потенциал является экстенсивным и аддитиьным свойством системы, то, естественно, что его значение может быть получено с помощью конкретных величин изобарных потенциалов, имеющихся для других реакций. [32]
Поскольку изобарный потенциал является экстенсивным и аддитивным свойством системы, то, естественно, что его значение может быть получено с помощью конкретных величин изобарных потенциалов, имеющихся для других реакций. [33]
Изменение изобарного потенциала для этой реакции показывает, что в водороде карбиды хрома, марганца, вольфрама, циркония восстанавливаются при температуре327 - 527 С. Для предотвращения обезуглероживания стали в водороде в него вводят метай СН4, который активно взаимодействует со сталью при температуре 577 - 677 С. [34]
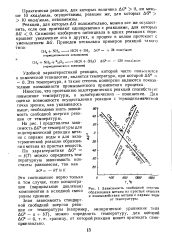 |
Зависимость свободной энергии. [35] |
Снижение изобарного потенциала в одних реакциях перекрывает увеличение его в других, и процесс в целом протекает с уменьшением ДО. [36]
Изменение изобарного потенциала в реакции диссоциации определяется ур. [37]
Использование изобарного потенциала дает количественную оценку движущей силе процесса. [38]
Расчет изобарных потенциалов, констант равновесий и степеней равновесного превращения всевозможных реакций взаимодействия НС1 с галлием [5] показал, что процесс гидрохлорирования сопровождается образованием моно -, ди - и трихлорида галлия. Наконец, монохлорид галлия может взаимодействовать с НС1 с образованием ди - и трихлорида галлия. [39]
Изменение изобарного потенциала, как и любого другого свойства системы, определяется только ее исходным и конечным состояниями. [40]
Вычисление изобарного потенциала следует производить для тех агрегатных состояний веществ, в которых они находятся в процессе реакции. Если одно или несколько веществ по ходу реакции конденсируются и превращаются в несмешивающиеся между собой фазы, при чем в уравнениях для констант равновесия мы их концентрации в газовой фазе не учитываем, как это будет показано ниже, то величины для определения AZ реакции берутся для тех фаз, в виде которых кажцый из компонентов системы участвует в реакции. [41]
Изменение изобарного потенциала в реакции диссоциации определяется ур. [42]
 |
Изобарный потенциал бинарного раствора. [43] |
Величина изобарного потенциала одного моля раствора G зависит от состава раствора. На рис. V, 5 схематически показана такая зависимость для бинарного раствора, состоящего из двух жидких компонентов Аи В, смешивающихся во всех отношениях. Эта зависимость изображается кривой GAGGB, выпуклой вниз на всем протяжении. Любая точка G этой кривой лежит ниже точки G на прямой GAGB, которая отвечает изобарному потенциалу системы, состоящей из компонентов А и В, взятых в тех же количествах, что и в растворе, но не смешанных друг с другом. [44]
Расчеты изобарных потенциалов и констант равновесия различных реакций легко выполняются путем комбинирования изобарных потенциалов реакций образования соединений из простых веществ. Стандартный изобарный потенциал любой химической реакции равен алгебраической сумме соответствующих величин для реакций образования всех участников реакции. Таблицы стандартных изобарных потенциалов образования химических соединений при 1 атм и 25 С являются важнейшей сводкой исходных данных для термодинамических расчетов. Эти табличные данные в большинстве случаев вычислены путем комбинации данных для других реакций. Поэтому они связаны с ошибками опыта, которые суммируются при сочетании величин ДО0 и могут составить большую относительную величину, если значение ДО0 образования невелико и получено путем вычитания больших величин. [45]
Страницы: 1 2 3 4