Стандартный изобарный потенциал - образование
Cтраница 1
Стандартные изобарные потенциалы образования не измеряются непосредственно. [1]
Стандартные изобарные потенциалы образования ( AZ) для различных соединений вычислены и сведены в соответствующие таблицы. [2]
Стандартный изобарный потенциал образования соединения при температуре УД / О ( чаще всего при 298 К AfG e) равен изменению изобарного потенциала реакции образования 1 моль этого соединения при давлении р 101 кПа и данной температуре Т из простых веществ, находящихся в стандартном состоянии. [3]
 |
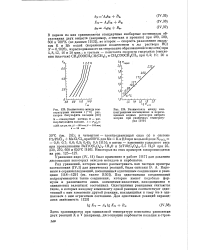
Стандартные изобарные потенциалы образования нек-рых сульфидов. [4] |
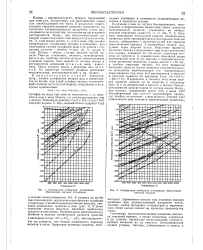
Стандартные изобарные потенциалы образования нек-рых окислов. [5]
Таблица стандартных изобарных потенциалов образования соединений используется как для оценки возможности протекания той или иной реакции, так и для количественных расчетов химического равновесия. Возможность осуществления данной реакции определяется знаком и величиной стандартного изобарного потенциала реакции. Отрицательный знак изобарного потенциала свидетельствует о возможности самопроизвольного протекания процесса, так как при реакции будет уменьшаться величина изобарного потенциала. Реакция не может протекать в случае положительной величины изобарного потенциала реакции, так как она должна сопровождаться возрастанием изобарного потенциала и, следовательно, затратой работы. [6]
Таблицы стандартных изобарных потенциалов образования химических соединений при 1 атм и 25 С являются важнейшей сводкой исходных данных для термодинамических расчетов. Эти табличные данные в большинстве случаев вычислены путем комбинации данных для других реакций. Поэтому они связаны с ошибками опыта, которые суммируются при сочетании величин AG и могут составить большую относительную величину, если значение AG образования невелико и получено путем вычитания больших величин. [7]
Задачу определения стандартного изобарного потенциала образования органических веществ можно значительно упростить с помощью структурных зависимостей, которые позволяют предсказать большое число значений AZ по немногим измеренным значениям. [8]
Дифторамин NF2H, стандартный изобарный потенциал образования которого отрицателен, также термодинамически стабилен и не разлагается на элементы вплоть до температур - 500 К, когда AGr становится равным нулю. [9]
В первом из них сравниваются стандартные изобарные потенциалы образования двух веществ ( например, н-пентана и пропана) при 400, 500, 600 и 700 К ( по данным [ ИЗ ]), во втором - скорость разложения амальгам К и Rb водой ( выраженная количеством п мл раствора НС1 N 0 1026), израсходованного на титрование образовавшейся щелочи) при 4, 8 12, 16 и 20 мин. [11]
На рис. 20 приведены графики изменения стандартного изобарного потенциала образования некоторых углеводородов в зависимости от температуры при атмосферном давлении. Поэтому термодинамически вероятность образования этилена из этана при температурах ниже 1000 невелика. [12]
СП, 103), если имеются молярные стандартные изобарные потенциалы образования веществ, участвующих в реакция. [13]
В этом же ряду уменьшаются теплоты образования и стандартные изобарные потенциалы образования. По мере увеличения молекулярного веса в ряду H3As - H3Sb - BiH3 температуры плавления и кипения повышаются. [14]
Таблицы содержат значения четырех основных термодинамических свойств веществ при 25 С: стандартной теплоты ( энтальпии) образования Л 298, стандартного изобарного потенциала образования AGlgs, стандартной энтропии S 9s и стандартной теплоемкости С р Кроме того, для ряда веществ приведены значения гипотетической теплоты ( энтальпии) образования Д / / при О К. [15]
Страницы: 1 2