Стандартный потенциал - металлический электрод
Cтраница 1
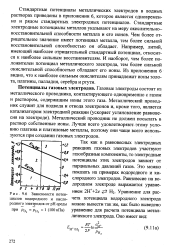 |
Зависимости потенциалов водородного и кислородного электродов от рН среды. [1] |
Стандартные потенциалы металлических электродов в водных растворах приведены в приложении 6, которое является одновременно и рядом стандартных электродных потенциалов. Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Из приложения 6 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [2]
Стандартные потенциалы металлических электродов в водных растворах приведены в табл. VII. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. [3]
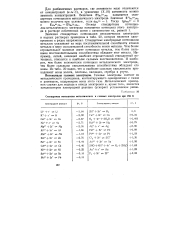 |
Стандартные потенциалы металлических и газовых электродов при 298 К. [4] |
Значения стандартных потенциалов металлических электродов в водных растворах приведены в табл. 20, которая является одновременно и рядом напряжения. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы. Из табл. 20 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [5]
Рассмотрим соотношение между стандартными потенциалами металлического электрода в растворе простых ионов и растворе, содержащем комплексы одного вида. [6]
Эту величину легко рассчитать по стандартным потенциалам металлических электродов и стандартным окислительно-восстановительным потенциалам. [7]
Величина Еме / ме называется стандартным потенциалом металлического электрода. [8]
Относительно потенциала стандартного водород - ного электрода, принятого за нуль, все стандартные потенциалы металлических электродов будут или по-ложительнее, или отрицательнее его. [9]
Если измеряется потенциал этого образца, то его величина должна заключаться где-то между стандартным потенциалом металлического электрода стандартным потенциалом кислородного электрода. Обе реакции будут поляризованы одна относительно другой, и истинные поляризационные кривые будут определяться соображениями, высказанными выше при рассмотрении растворения металла. [10]
Существенное влияние на скорость саморазряда оказывают загрязнения, попадающие в электролит или электроды. Примеси металлов, имеющиеся в металлических электродах, вызывают усиленную коррозию вследствие возникновения микроскопических местных элементов. Особенно повышается коррозия при загрязнении металлами с малым перенапряжением выделения водорода и стандартным потенциалом более положительным, чем стандартный потенциал металлического электрода. [11]
Существенное влияние на скорость саморазряда оказывают загрязнения, попадающие в электролит или в электроды. Примеси металлов, имеющиеся в металлических электродах, вызывают усиленную коррозию вследствие возникновения микроскопических местных элементов. Особенно повышается коррозия при загрязнении металлами с малым перенапряжением водорода и стандартным потенциалом, более положительным, чем стандартный потенциал металлического электрода. [12]
Страницы: 1