Приложенный потенциал
Cтраница 2
 |
Амперометрическое титрование арсенита броматом ( по Лейти-нсну и Кольтгофу. [16] |
При данном значении приложенного потенциала восстановления кислорода на катоде не происходит и, следовательно, не нужно удалять кислород из раствора перед анализом. [17]
Титрование проводят при приложенном потенциале - 0 3 в относительно НКЭ. Цистин для определения превращают в цистеин в освобожденном от воздуха буферном растворе под действием избытка 0 025 - 0 1 М раствора Na2SO3 или путем восстановления встряхиванием образца, содержащего 0 3 - 1 мг цистина и 0 05 М H2SO4, в течение 30 мин с одной каплей 1 % - ной амальгамы натрия. Если начальная концентрация цистеина меньше 5 - 10 - 4 М, то конечная точка титрования становится более резкой с увеличением разбавления. Присутствие хлорида, сульфата, фосфата и органических коагулянтов белков не мешает определению. Анализу мешают небольшие количества бромида, цианида и иодида ( если их молярное отношение к цистеину больше одной пятой) и другие ионы, которые дают нерастворимые соли в аммиачной среде, например цинк, кадмий, медь и кобальт. Титрование нужно проводить быстро, чтобы конечная точка соответствовала образованию цистеината серебра. [18]
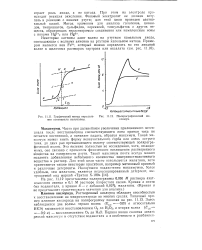 |
Графический метод определения потенциала полуволны.| Полярографический максимум. [19] |
Часто при дальнейшем увеличении приложенного потенциала после восстановления соответствующего иона кривая тока не остается постоянной, а начинает падать, образуя максимум. Такой максимум может иметь форму незначительного горба или очень острого пика, до двух раз превышающего высоту соответствующей полярографической волны. Это явление полностью не исследовано, хотя, по-видимому, оно связано с процессом физического поглощения растворенного вещества на поверхности ртути. [20]
В системе металл-вакуум падение приложенного потенциала растянуто на все межэлектродное пространство. Поэтому, если к границе металл-вакуум приложить разность потенциалов порядка нескольких вольт ( характерную для системы электрод - раствор электролита), она, относительно равномерно рассредоточившись на макроскопическом расстоянии, не вызовет практически никаких изменений на расстояниях порядка толщины собственно межфазной границы. [21]
Кривая потенциальной энергии для приложенного потенциала Vi показана сплошной линией, причем на рисунке указаны энергии активации Еа и Ес в анодном и катодном направлениях. [22]
Кривая потенциальной энергии для приложенного потенциала Vi показана сплошной линией, причем на рисунке указаны энергии активации Еа и ЕС в анодном и катодном направлениях. [23]
Кривая зависимости поверхностного натяжения от приложенного потенциала называется электрокапиллярной кривой. [24]
Кривая зависимости периода капания от приложенного потенциала имеет форму параболы. [25]
Это значение не зависит от величины приложенного потенциала, а следовательно, и от силы тока. [26]
При определении порядка реакций для отнесения приложенного потенциала, константы скорости и концентрации к реакции переноса электрона доступны обычные методы. [27]
В амперометрии измеряется диффузионный ток при соответствующем приложенном потенциале и уравнение ( 8 - 1) непосредственно, применяется для определения концентрации какой-либо формы. Пуш [57] определил константу диссоциации карбоновой кислоты амперометрическим методом в 1916 г. Однако химики много лет не признавали ам-перометрию, и этим методом было определено лишь несколько констант устойчивости. [28]
Ток эмиссии / дан в амперах, приложенный потенциал К - в вольтах. [29]
Начертить вероятные кривые амперометрического титрования меди сс-бензоиноксимом, если приложенный потенциал равен - 0 35 в; - 1 0 в и - 1 8 в. Какой потенциал следует предпочесть при определении меди в отсутствие мешающих катионов. [30]
Страницы: 1 2 3 4 5