Вертикальный потенциал - ионизация
Cтраница 1
Вертикальные потенциалы ионизации [199] равны: 18 2; 14 2; 14 97; 17 91 эв. [1]
ЕВЗМО - вертикальный потенциал ионизации, который не учитывает того, что при отрыве электрона от молекулы происходит реорганизация ее ядерной и электронной конфигурации. [2]
Обычно говорят, что эта энергия равна вертикальному потенциалу ионизации молекулы, который больше адиабатического на величину энергии колебательного возбуждения иона. Так, вертикальный потенциал ионизации водорода близок к 16 0 эв. [3]
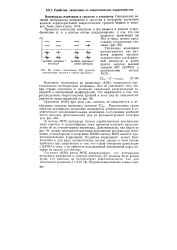 |
Схема заполнения МО уровней приближении метода. [4] |
Величины, получаемые по уравнению (8.58), называются вертикальными потенциалами ионизации. Они не учитывают того, что при отрыве электрона от молекулы происходит реорганизация ее ядерной и электронной конфигурации. [5]
В случае молекул в качестве I использован так называемый вертикальный потенциал ионизации, отвечающий франк-кондоновскому переходу. [6]
При использовании бомбардировки электронами следует проводить различие между понятиями вертикального потенциала ионизации и потенциала ионизации, который можно было бы назвать минимальным. Поэтому если энергия электронов такова, что ток ионов А максимален, то электрон может удалиться от М настолько быстро, что А и В не успеют разойтись и в результате последующего разделения А и В приобретут заметную кинетическую энергию. Вертикальный потенциал ионизации отличается от минимального потенциала, требуемого для образования А и В, на величину полной кинетической энергии, сообщаемой осколкам молекул. [7]
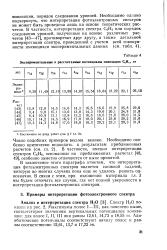 |
Экспериментальные и рассчитанные потенциалы ионизации С6НГ, эв. [8] |
Максимумы полос I-III, как пояснено выше, соответствуют значениям вертикальных потенциалов ионизации: для полос I, II, III они равны 12 61, 14 73 и 18 55 за. Адиабатические потенциалы соответствуют началу полос и равны соответственно 12 61, 13 7 и 17 22 эв. [9]
Потенциалы ионизации, определенные методом фотоионизации в [43], являются вертикальными потенциалами ионизации. [10]
Орбитальная энергия электрона на верхнем занятом уровне в So-состоянии, соответствующая вертикальному потенциалу ионизации, увеличивается ( абсолютная величина уменьшается) с ростом размера молекулы и уменьшением доли бензоидных ( секстет-ных) колец. При одинаковом числе колец увеличение доли бензоидных приводит к резкому уменьшению потенциала ионизации. Орбитальная энергия возбужденного электрона в р-состоянии в полиаценах и полифенилах понижается примерно на 2000 - 3000 см 1 с увеличением молекулы на одно кольцо. Энергия Ер в ортоконденсированных углеводородах примерно соответствует энергии полиаценового фрагмента молекулы. Орбитальная энергия электрона в a -, TI -, Р - СОСТОЯНИЯХ мало зависит от структуры молекул. Ет соответствующая интенсивному Т - Га-поглощению в видимой области, понижается в полифенилах на 4000 - 5000 см 1 и полиаценах на 1000 - 2000 см 1 при увеличении мол екулы на одно кольцо. [11]
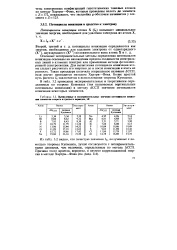 |
Вычисленные экспериментальные значения иютенщиалов нониза-шш элементов второго третьего иерводов, эВ. [12] |
В табл. 3.2 приведены экспериментальные и теоретически определяемые по теореме Купманса ( так называемые вертикальные потенциалы ионизации) и методу АССП значения потенциалов ионизации некоторых элементов. [13]
Анализ кривых эффективности фотоионизации ( КЭФ) и фотоэлектронных ( ФЭ) спектров дает возможность определять адиабатические и вертикальные потенциалы ионизации молекул, энергии колебательных и электронных уровней возбуждения ионов. Адиабатические потенциалы ионизации молекул дают информацию об энергетической структуре заполненных валентных орбиталей молекул, поскольку энергии ионизации приближенно равны энергии соответствующих молекулярных орбиталей с обратным знаком. [14]
В первом случае межъядерное равновесное расстояние одинаково для молекулы и молекулярного иона ( кривая а); при этих условиях вероятность перехода между основными колебательными состояниями, определяемая интегралом перекрывания, будет большой, а вертикальный потенциал ионизации будет также и адиабатическим. Во втором случае, не показанном на графике, перекрывание волновых функций для низших колебательных состояний меньше, и хотя все же имеется вероятность, что квантовое число останется неизмененным, наблюдается значительное перекрывание волновых функций низшего колебательного состояния молекулы и высшего состояния иона. Несмотря на то, что обычно в результате перехода всегда образуется стабильный молекулярный ион, некоторые из ионов переходят в возбужденное колебательное состояние. [15]
Страницы: 1 2