Измеряемый потенциал
Cтраница 2
Показано, что падение измеряемого потенциала протекания для диафрагм из тонкодисперсных порошков определяется в первую очередь увеличением проводимости раствора в порах диафрагм. [16]
В ряде случаев удобнее относить измеряемый потенциал не к водородному электроду в том же растворе, а к постоянному электроду сравнения, потенциал которого не меняется при изменении [ IHA - Потенциал, отнесенный к такому электроду, обозначим через ср. [17]
Учитывая вышеизложенные воззрения на природу измеряемого потенциала и резкое снижение плотности тока в первой, ближайшей к точке дренирования тока, зоне, следует объяснить пик вблизи точки дренирования тока на кривой распределения потенциалов катодных станций сильным уменьшением омического падения потенциала, при малом изменении поляризации. [18]
В некоторых случаях удается добиться стационарности измеряемого потенциала. Вместе с тем и в этом случае мы можем говорить лишь о какой-то инструментальной величине, а не о термодинамически строгой функции. Кроме того, технологические растворы ЦБП представляют собой многокомпонентные системы, содержащие целую гамму составляющих, различающихся по своим редокс-свойствам. В таких системах окислительные потенциалы, как правило, прямо не связаны с окислительно-восстановительным уровнем исследуемых растворов. В них потенциалопреде-ляющие процессы на электродах необратимы, и потенциал навязывается одной системой с наибольшим током обмена. Эта система вообще может не иметь места в исследуемом растворе, а образовывается на поверхности электрода в результате каталитического взаимодействия его поверхности с исследуемым раствором. В качестве последнего применяют обратимую окислительно-восстановительную систему, например редокс-индикаторы, феррициа-нид-ферроцианид калия и др. Если медиатор не изменяет механизма объемных окислительно-восстановительных реакций, быстро реагируя на изменение значений потенциала, с его помощью удается выяснить как кинетику процессов, так и механизм протекающих реакций. Так, в [90] при оценке редокс-свойств лигнина в процессе щелочных обработок использованы в качестве медиаторов ализарин S и индигокармин. [19]
Электрохимическая гетерогенность поверхности определяет также величину измеряемого потенциала и его изменение Дер под влиянием деформации. Это связано с тем, что локализация активированных анодных процессов с ростом деформации увеличивает действующую площадь катодов ( или менее эффективных анодов), что ведет к уменьшению сдвига стационарного потенциала. [20]
Окислительно-восстановительные системы здесь во многих случаях необратимый непосредственно измеряемые потенциалы не всегда совпадают с рассчитанными из термодинамических данных. [21]
Следовательно, возникает вопрос о - равновесности измеряемых потенциалов намазных феррицениевых электродов. [22]
Любые изменения потенциала между жидкими фазами влияют на измеряемый потенциал гальванического элемента; наличие этого неучитываемого влияния препятствует более широкому распространению прямой аналитической потенциометрии. В наиболее распространенных аналитических методах, основанных на прямой потенциометрии ( особенно при измерении рН), пользуются эмпирическими калибровочными кривыми; это позволяет свести к минимуму влияние ошибок, связанных с потенциалами между жидкими фазами. [23]
Определялись те места, где были зафиксированы всплески измеряемого потенциала на фоне монотонно меняющегося силового поля. [24]
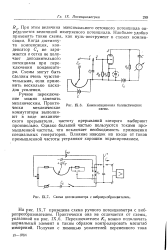 |
Схема потенциометра с вибропреобразователем. [25] |
При этом величина максимального сеточного потенциала определяется величиной измеряемого потенциала. Наиболее удобно применять такие схемы, как нуль-инструмент в схемах компенсации. Когда достигнута компенсация, конденсатор С1 не заряжается и сетка не получает дополнительного потенциала при переключении конденсатора. Схемы могут быть сделаны очень чувствительными, если применить несколько каскадов усиления. [26]
 |
Схема калий-селективного микроэлектрода. [27] |
Следует заметить, что при измерениях в одной клетке измеряемый потенциал необходимо корректировать на величину ее мембранного потенциала. Последний измеряют с помощью микропипетки, введенной в клетку и соединенной с электродом сравнения. [28]
Для этих четырех исследованных соединений была установлена линейная зависимость измеряемого потенциала от логарифма концентрации тиола. Растворы этих четырех тиолов сохраняли постоянное значение потенциала по крайней мере 4 ч, что указывало на отсутствие быстрого окисления. Для других исследованных тиолов, именно этандитиола-1 2 и тиофенола, потенциал изменялся со временем. [29]
Для этих четырех исследованных соединений была установлена линейная зависимость измеряемого потенциала от логарифма концентрации тиола. [30]
Страницы: 1 2 3 4