Высокий катодный потенциал
Cтраница 2
Применяя материал, на котором водород выделяется с большим перенапряжением, можно получить более высокий катодный потенциал и, следовательно, большую энергию восстановления без выделе -, яия газообразного водорода. Кроме того, материал катода может оказывать каталитическое действие на процесс вос-гтановденвя. [16]
Исследователи, изучая процессы КРН при высоком рН, также отмечают, что важную роль в процессе растрескивания в рассматриваемом случае играют сезонные колебания, контролирующие изменения параметров грунтовых электролитов. Для того, чтобы образовалась концентрированная среда с высоким значением рН, должен быть достаточно высокий катодный потенциал. [17]
Несмотря на отсутствие поляризации, с поверхности бурно выделяются пузырьки газа с постепенным уменьшением их по мере спада потенциала. Появление на гладкой поверхности вальцованного электрода макроскопических вздутий после электролиза при 80 или длительной поляризации при высоких катодных потенциалах при 25 указывает на значительное давление водорода в объеме металла. Последнее, по-видимому, связано с изменением характера газовыделения: на катоде образуются более крупные пузырьки и исчезает газовая эмульсия в католите. [18]
Металлы IV, V и VI групп периодической системы ( и в первую очередь - титан, цирконий, тантал) характеризуются средним значением перенапряжения водорода. Выделение последнего на этих металлах идет на покрывающих поверхность оксидных пленках, образование которых происходит при достаточно высоких катодных потенциалах. Полупроводниковые и электрокаталитические свойства этих пленок определяют значения перенапряжения водорода. [19]
С тех же исходных позиций объясняется и открытое Б. И. Кабановым, И. И. Астаховым и И. В. Киселевой внедрение электроотрицательных металлов, таких, как натрий, в свинец при электролизе водного раствора, например сульфата натрия, со свинцовым катодом. Наряду с основным катодным процессом - выделением водорода по реакции 2Н20 2е Hz 2ОН - - при высоких катодных потенциалах идет разряд ионов натрия с образованием интерметаллнческих соединений. [20]
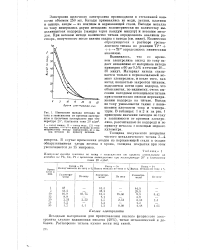 |
Изменение выхода металла по току и зависимости от времени электролиза в щелочном электролите при температуре 20, плотности тока 20 а / дм2. [21] |
Выяснилось, что со временем электролиза выход по току падает независимо от материала катода примерно с 60 до 0 5 % в течение 20 - 30 минут. Материал катода сказывается только в первоначальный момент электролиза, и после того, как катод полностью закроется титаном, выделяется почти один водород, что объясняется, по-видимому, очень высоким катодным потенциалом титана при относительно низком перенапряжении водорода на титане. Выход по току уменьшается также с повышением плотности тока и температуры. В таблицах 1 и 2 и на рис. 1 приведены значения выходов по току в зависимости от времени электролиза, рассчитанные по водороду и по привесу металла с помощью медного кулометра. [22]
На катодной поляризационной кривой имеется один прямолинейный участок, заканчивающийся предельным током. При введении хлористого лития появляется второй участок, соответствующий совместному разряду лития и кальция. В области высоких катодных потенциалов протекают еще два процесса, по-видимому, связанные с последовательным восстановлением продуктов взаимодействия свежеосажденного лития с растворителем. [23]
В растворах неактивных веществ зона положительных максимумов располагается от 0 до - 0 6 в. Отрицательные максимумы соответствуют отрицательной ветви электрокапиллярной кривой. Практически это означает, что отрицательные максимумы лежат от - 0 6 и далее в сторону более высоких катодных потенциалов. Гейровский показал, что подавление положительных максимумов может быть достигнуто введением отрицательно заряженных ионов, особенно если они являются многовалентными. Еще более эффективное подавление положительных максимумов достигается добавлением кислых красителей и отрицательных коллоидов. Отрицательные максимумы часто подавляются многовалентными катионами, основными красителями или положительно заряженными коллоидами. Подавления максимума во многих случаях удается достигнуть добавлением желатины, клея, агар-агара и других подобных веществ. На рис. П2 сплошная линия показывает ход подпрограммы при добавлении фуксина к анализируемому раствору. Как видно из чертежа, указанная добавка полностью подавила максимумы и позволила успешно измерять концентрацию ионов свинца и кадмия по высоте соответствующих полярографических волн. [24]
Характерно, что при предварительном окислении электродов выдержкой в электролите в течение 24 ч минимум катодного перенапряжения становится более пологим и сдвигается к 30 ат. Восстановление окислов металлов ( при данной скорости снятия кривых i - ф) происходит, по-видимому, при более высоких катодных потенциалах. [25]
Это деление производится на основании общеизвестных законов электрохимии, соответственно роду электролиза и кислому или основному характеру электролита. Из кислого раствора осаждаются при 80 - 90 Hg, Ag, Pb, Bi, Cu, As, Sb, Sn, а из сильно аммиачного раствора, при высокой плотности тока, высоком катодном потенциале и при обыкновенной температуре - выделяются элементы Со, Ni, Cd, Zn, Mo. Марганец осаждается на аноде. В электролите остаются в качестве гидроокисей Cr, Fe, A1, а в растворе щелочные и щелочио-земельные металлы. Электролитическое осаждение происходит на медной или платиновой сетке, которые и подвергаются действию конденсированной искры. [26]
Нерастворимыми остаются сульфиды и селениды металлов, благородные металлы, а также углерод и остатки шлака. Эти вещества в процессе рафинирования никеля и образуют шлам. В шлам, составляющий 3 - 5 % массы анодов, переходит и значительное количество меди, которое зависит от содержания серы в аноде, а также до 1 % содержащихся в аноде никеля, кобальта и железа. С другой стороны, высокий катодный потенциал, достигающий при выделении никеля минус 0 65 - минус 0 7В, приводит к тому, что совместно с никелем на катоде разряжаются не только Н2, но и почти все примеси. [27]
Повышение температуры влияет в основном в трех направлениях: 1) понижает перенапряжение, 2) повышает скорость химических стадий реакции и 3) увеличивает скорость диффузии деполяризатора к катоду. Фактическое влияние повышения температуры на электролитическое восстановление является суммарным результатом всех этих факторов. Если процесс восстановления не требует слишком высокого перенапряжения, то можно ожидать, что повышение температуры вследствие действия второго и третьего факторов улучшит выход по току при восстановлении. Если, с другой стороны, процесс требует высокого катодного потенциала, то повышение температуры, поскольку оно понижает перенапряжение, будет сопровождаться уменьшением выхода по току. [28]
Создать такие условия в промышленном электросинтезе чрезвычайно трудно. Чтобы ускорить процесс, надо резко повысить потенциал, но при высоком катодном потенциале начинается интенсивное выделение водорода, а при анодном - кислорода. В полярографии область рабочих потенциалов не превышает 2 7 в ( чаще 2 0 в), причем весь потенциал сосредоточен на одном из электродов - на микроэлектроде, а промышленный электросинтез идет при 5 - 10 в, которые распределяются между обоими электродами. Да и измеряют в последнем случае чаще всего не потенциал электрода, а плотность тока, которая говорит о величине потенциала, но весьма приблизительно. [29]
Описана [7] возможная ситуация при восстановлении органических соединений в ГМФА. При низких плотностях тока идет прямое электрохимическое восстановление вещества. При повышении плотности тока вследствие кинетических или диффузионных ограничений скорость процесса замедляется, что приводит к возрастанию потенциала катода до потенциалов генерации электронов. Дальнейший процесс идет по двум механизмам - электрохимическому и химическому по реакции с сольватированными электронами. При высоких плотностях тока процесс в основном может идти по второму пути. Другой вариант - прямое восстановление органического соединения на катоде - не может идти вследствие невозможности переноса электрона к веществу из-за энергетических затруднений. В этом случае процесс протекает при высоких катодных потенциалах через химическое взаимодействие с сольватированными электронами. [30]
Страницы: 1 2 3