Нормальный потенциал
Cтраница 1
Нормальный потенциал Ей окислительно-восстановительной системы иод - иодид ( J2 / 2J -) равняется 0 53 в н занимает промежуточное положение между потенциалами сильных окислителей и сильных восстановителей. Поэтому иодометрические методы применяются при определениях как окислителей, так и восстановителей. Вещества, окислительный потенциал которых меньше окислительного потенциала иод - иодид, окисляются иодом, с другой стороны, иодиды восстанавливают системы с большим окислительным потенциалом, выделяя эквивалентное количество свободного иода. Выделившийся иод обычно отти-тровывают раствором тиосульфата натрия. [1]
Нормальные потенциалы в уравнениях (1.131) и ( 1.131) по [ 601 имеют значения фн. Сопоставление нормальных потенциалов в уравнениях (1.131) и ( 1.131) с соответствующими потенциалами в уравнениях (1.130) и ( 1.130) показывает, что перекись водорода в условиях восстановления молекулярного кислорода не является термодинамически стабильным веществом. [2]
Нормальный потенциал 1 4-нафтохинона в этаноле 0 484В, а 2-фениламино - 1 4-нафтохинона 0 286 В. Фениламино-1 4-нафтохинон получают взаимодействием 1 4-нафтохинона с анилином. В каких соотношениях следует взять реагенты, чтобы получить 1 моль 2-фениламино - 1 4-нафтохинона. [3]
Нормальный потенциал Cu2 Cu электрода 0 344 в, а Zn2 Zn равен - 0 718 в. Следует обратить внимание на то, что знак полуэлемента принимают разным в зависимости от порядка его записи. Если электрод записан в обратном порядке, то для него принимают противоположный знак. Например, для Cu Cu2 электрода следует принять потенциал равным - 0 344 в, а для Zn Zn2 электрода - равным 0 718 в. Знак потенциала полуэлемента зависит не только от того, каков знак полуэлемента в цепи с водородным электродом, но и от направления записи цепи. При этих правилах знаков электродвижущая сила элемента равна сумме численных значений электродных потенциалов и всегда положительна независимо от знака суммы. [4]
Нормальный потенциал Е окислительно-восстановительной системы иод - иодид ( 12 / 21) равняется 0 53 в и занимает промежуточное положение между потенциалами сильных окислителей и сильных восстановителей. Поэтому иодометрические методы применяются при определениях как окислителей, так и восстановителей. Вещества, окислительный потенциал которых меньше окислительного потенциала иод - иодид, окисляются иодом, с другой стороны, иодиды восстанавливают системы с большим окислительным потенциалом, выделяя эквивалентное количество свободного иода. Выделившийся иод обычно отти-тровывают раствором тиосульфата натрия. [5]
Нормальный потенциал этой системы, равный. [6]
Нормальные потенциалы, определяющие положение элементов в ряду напряжений, установлены еще не для всех металлов главной подгруппы II группы при помощи непосредственных измерений. В табл. 46, кроме измеренных нормальных потенциалов, приведены значения, вычисленные Макишима Makishima, ср. Из данных таблицы видно, что элементы главной подгруппы II группы по силе своего электроположительного характера значительно приближаются к щелочным металлам. [7]
Нормальный потенциал, отнесенный к нормальному водородному электроду, в соответствии с уравнением ( 3) гл. Из приведенных в табл. 46 значений нормальных потенциалов ( с учетом нормального потенциала хлора) вычислены приведенные в табл. 47 потенциалы разложения хлоридов группы щелочноземельных металлов, относящиеся к водным растворам. [8]
Нормальный потенциал, соответствующий перезаряжению РЬ - РЬ ( ср. [9]
Нормальные потенциалы, определяющие положение элементов в ряду напряжений, установлены еще не для всех металлов главной подгруппы II группы при помощи непосредственных измерений. В табл. 46, кроме измеренных нормальных потенциалов, приведены значения, вычисленные Макишима ( Makishima, ср. Из данных таблицы видно, что элементы главной подгруппы II группы до силе своего электроположительного характера значительно приближаются к щелочным металлам, Последовательность нормальных потенциалов здесь та же, что и последовательность потенциалов ионизации. Эффект гидратации ионов, оказывающий в ряду щелочных металлов сильное влияние на величины их нормальных потенциалов, в ряду щелочноземельных металлов отступает на второй план. Это связано с тем, что разности между теплотами гидратации и энергиями ионизации ( см. табл. 46) в группе щелочноземельных металлов значительно больше, чем в группе щелочных металлов. В обеих группах теплоты гидратации ионов меньше, чем энергии ионизации, и значительно меньше, чем сумма последних и теплот сублимации. Металлы обеих групп вытесняют водород из воды и кислот и в соответствии с этим обнаруживают отрицательный потенциал по отношению к водородному электроду. [10]
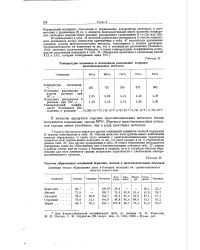 |
Теплоты образования соединений бериллия, магния и щелочноземельных металлов. [11] |
Нормальный потенциал, отнесенный к нормальному водородному электроду, в соответствии с уравнением ( 3) гл. Из приведенных в табл. 46 значений нормальных потенциалов ( с учетом нормального потенциала хлора) вычислены приведенные в табл. 47 потенциалы разложения хлоридов группы щелочноземельных металлов, относящиеся к водным растворам. [12]
Нормальный потенциал, соответствующий перезаряжению РЬ - РЬ ( ср. [13]
Нормальный потенциал 2-хлор - 1 4-бензохинона выше, чем у 1 4-бензохи-нона. Напротив, нормальные потенциалы 2-метокси - и 2 5-диметоксигидрохинонов ниже, чем нормальный потенциал 1 4-бензохинона. [14]
Нормальный потенциал ( р0) системы гидрохинон - хинон можно найти, заменяя в этом уравнении концентрации [ хинон ] и [ гидрохинон ] объемами веществ, израсходованных при титровании. [15]
Страницы: 1 2 3 4