Нормальный потенциал - металл
Cтраница 3
В каких случаях сравнительная активность металлов может оцениваться по величинам ионизационных потенциалов их атомов и в каких случаях - по величинам нормальных потенциалов металлов. [31]
Широко используют при оценке защитной эффективности масел и ингибиторов коррозии методы, перечисленные в предыдущем разделе: определение полярности и поляризуемости, определение контактной разности потенциалов и нормального потенциала металлов. [32]
Так как потенциал полуволны при обратимом восстановлении находится в простом отношении к нормальному потенциалу металла, можно предполагать что влияние растворителей на потенциалы полуволн - будет иметь тот же характер, что и на нормальные потенциалы металлов ( см. гл. [33]
Так как потенциал полуволны при обратимом восстановлении находится в простом отношении к нормальному потенциалу металла, можно предполагать, что влияние растворителей на потенциалы полуволн будет иметь тот же характер, что и на нормальные потенциалы металлов ( см. гл. [34]
Потенциал металла, помещенного в раствор своих собственных ионов, концентрация которых составляет 1 Г - моль / л, называется нормальным потенциалом данного металла. Нормальный потенциал металла по сравнению с потенциалом нормального водородного электрода, принятого за нуль, может быть положительным или отрицательным. [35]
В связи с этим вводится понятие нормального потенциала металла, характеризующее разность потенциалов между этим металлом, погруженным в раствор его соли, и нормальным водородным электродом, условно принятым равным нулю. Нормальные потенциалы металлов ( В) приведены ниже. [36]
Если нормальный потенциал металла более электроотрицателен, чем водород, то при электролизе выделяется водород, а не металл. В этих случаях целесообразно использовать катод, на котором возникает сильное перенапряжение, например, свинец или ртуть. [37]
Нормальные потенциалы металлов берутся со знаком минус, когда потенциал металла ниже потенциала водородного электрода, и со знаком плюс, когда потенциал металла выше его. Зная нормальные потенциалы металлов, легко определить электродвижущую силу любого гальванического элемента, состоящего из двух разных металлов, погруженных в растворы их солей. [38]
Суммарные энергии сольватации в аммиаке ( см. табл. 15) рассчитывались по данным Плескова. Смс) - из нормальных потенциалов металлов, полученных экспериментально. Это объясняется большей основностью аммиака и его более низкой диэлектрической пр опицаемостью. [39]
Таким образом, скорость процесса бестокового выделения радиоактивного элемента зависит не только от начальной разности потенциалов локального элемента, но также от величин катодной и анодной поляризации и омического сопротивления этого элемента. Поэтому простое сопоставление величин нормальных потенциалов металла электрода и выделяемого радиоактивного элемента не позволяет однозначно ответить на вопрос о возможности такого выделения. [40]
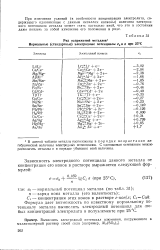 |
Ряд напряжений металлов1 Нормальные ( стандартные электродные потенциалы е0 в в при 25 С. [41] |
Сг - концентрация этих ионов в растворе г-ион / л; d Cak. Формула дает возможность по известному нормальному потенциалу металла вычислить электродный потенциал для любых концентраций электролита в полуэлементе при 25 С. [42]
Одни металлы могут быть получены из ионного состояния легко, другие с трудом. Это объясняется, с одной стороны, сильно различающимися значениями нормальных потенциалов металлов ( стр. [43]
Они рассчитывались из данных Плескова. Ал - расчитывалась по величине потенциалов Р1 ( Г2) Г - вычисленных Плесковым из растворимости, величина АХ - АХ1Л из нормальных потенциалов металлов, полученных экспериментально. Это объясняется большей основностью аммиака и его более низкой диэлектрической проницаемостью. [44]
С изменением концентрации ионов в растворе изменяется и величина потенциала металла. При 10-кратном изменении концентрации ионов в растворе ( при постоянной температуре) величина потенциала электрода изменяется на 0 029 в. Если нормальный потенциал металла отрицателен, то такой металл называется электроотрицательным, если же нормальный потенциал металла положителен, то металл называется электроположительным. [45]
Страницы: 1 2 3 4