Нормальный потенциал - электрод
Cтраница 1
Нормальный потенциал электрода Си Си2 равен 0 34 в. Присутствие свободной серной кислоты, снижая активность ионов Си2 в растворе, немного сдвигает потенциал медного электрода в сторону более отрицательных значений. [1]
Нормальным потенциалом электрода условно называют потенциал, измеренный относительно нормального водородного электрода при концентрации ионов металла в растворе, равной одному граммиону в литре. [2]
Ме - нормальный потенциал электрода Me / Mez, который для различных валентностей ионов металла имеет различные значения. [3]
Что называется нормальным потенциалом электрода и что такое нормальный окислительно-восстановительный потенциал. [4]
Как известно, нормальные потенциалы известных электродов, расположенные в порядке от наименьших значений до наибольших, образуют так называемый нормальный ряд напряжений металлов. [5]
Еа и Ео - нормальные потенциалы электродов ( находят по таблице ряд напряжений); а и az - активности ( для разбавленных растворов концентрации) ионов в растворах. [6]
При вычислении константы равновесия реакций обмена NaOH и нормального потенциала электрода D / D - - упомянутые авторы молчаливо предполагают одинаковую растворимость AgCI в обыкновенной и тяжелой воде, что, сравнивая с другими солями, для которых растворимости были непосредственно определены, маловероятно. [7]
При а 1 имеем Е Е0, следовательно, нормальный потенциал электродов первого рода представляет собой разность потенциалов между электродом и раствором, в котором активность одноименных ионов равна единице. [8]
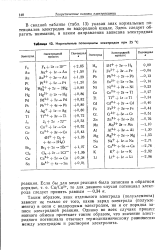 |
Нормальные потенциалы электродов при 25 С. [9] |
В сводной таблице ( табл. 13) указан знак нормальных потенциалов электродов по водородной шкале. [10]
Это выражение получено из уравнения Нернста в предположении, что диффузионный потенциал, нормальный потенциал электрода и коэффициенты активности измеряемого иона практически не изменяются при введении добавки. [11]
Для активности ионов металла, равной единице, потенциал электрода имеет определенную величину П, которая называется стандартным или нормальным потенциалом электрода металл - ион металла. [12]
В уравнении ( 19a): tAgci Ag 0 058 IgOPAgci является характерной величиной для данного полуэлемента, и ее можно рассматривать, как нормальный потенциал электрода второго рода. Таким образом, рассматриваемый электрод является одновременно обратимым как по отношению к катиону Ag, так и по отношению к аниону Ch. Последнее свойство является общим для всех электродов второго рода. Из уравнения ( 19а) также видно, что скачок потенциала электрода второго рода зависит от концентрации хорошо растворимого электролита. [13]
С - концентрация ( моль / л или г. ион / л); п - число электронов, участвующих в реакции; Е0 - нормальный потенциал электрода; R - газовая постоянная; F - число Фарадея; Т - абсолютная температура. [14]
ГМе в - прйэлектр Одтгон слоЕ; is - - соответствующий коэффициент активности иона Ме в растворе; ан-активность ртути в амальгаме; ео - нормальный потенциал электрода. [15]
Страницы: 1 2