Кажущийся нормальный потенциал
Cтраница 1
Кажущийся нормальный потенциал зависит от рН раствора. [1]
 |
Зависимость кажущихся окислительно-восстановительных потенциалов систем, содержащих марганец в различных степенях окисления, от рН раствора. [2] |
Повторим определение кажущегося нормального потенциала Ео ( см. стр. [3]
 |
Зависимость кажущихся окислительно-восстановительных потенциалов систем, содержащих марганец, в различных степенях окисления, от рН раствора. [4] |
Повторим определение кажущегося нормального потенциала EQ ( см. стр. [5]
Изучена зависимость кажущегося нормального потенциала системы ферри - ферро от состава растворителя уксусная кислота - вода. [6]
Во всех случаях можно графически представить значения кажущегося нормального потенциала как функцию концентра ции свободных ионов адденда в растворе, рассчитывая для этого значения кажущегося потенциала по константам нестойкости образующихся комплексов или определяя их экспериментально. [7]
Во всех случаях можно графически представить значения кажущегося нормального потенциала как функцию концентрации свободных ионов адденда в растворе, рассчитывая для этого значения кажущегося потенциала по константам нестойкости образующихся комплексов или определяя их экспериментально. [8]
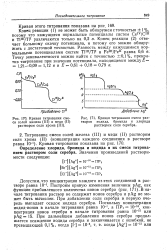 |
Кривая титрования смеси солей железа ( III и меди ( II раствором соли хрома ( III.| Кривая титрования смеси растворов иодида, бромида и хлорида раствором соли серебра. [9] |
Конец реакции ( 1) не может быть обнаружен с точностью 1 %, потому что кажущиеся нормальные потенциалы систем Се1У / Сш и Tlin / TlJ различаются только на 0 2 в. Конец реакции ( 2) отвечает большому скачку потенциала, и потому его можно обнаружить с достаточной точностью. [10]
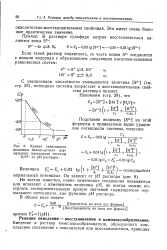 |
Кривая зависимости величины кажущегося нормального потенциала системы S / S2 от рН раствора. [11] |
Не всегда известно, какие химические соединения появляются или исчезают с изменением величины рН, но всегда можно построить экспериментальную кривую значений кажущегося нормального потенциала, как функцию рН раствора. [12]
 |
Кривая зависимости величины кажущегося нормального1 потенциала системы S / S2 от рН раствора. [13] |
Не всегда известно, какие химические соединения появляются или исчезают с изменением величины рН, но всегда можно построить экспериментальную кривую значений кажущегося нормального потенциала, как функцию рН раствора. [14]
Было найдено ( 233, 246, 258, 259 ], что концентрация аскорбиновой кислоты в растениях увеличивается при снабжении глюкозой. Условия, косвенно влияющие на образование сахара, например обильное снабжение двуокисью углерода и хорошее освещение, также увеличивали концентрацию аскорбиновой кислоты. Аскорбиновая кислота характерна своей кислотностью и способностью к обратимому окислению. Измерение окислительно-восстановительного потенциала дает величину, равную 9 1 Ю-6. Следовательно, в тканях почти вся аскорбиновая кислота должна находиться в виде анионов илп металлоорганического комплекса. Большая константа диссоциации на первый взгляд противоречит принятой формуле, так как в ней нет карбоксильной группы. Аскорбиновая кислота имеет величину i - 0 833; она может окисляться дальше, теряя два или даже четыре водородных атома. В определенном интервале рН такая потеря обратима, особенно поскольку дело касается первой ступени. Эта ступень превращает аскорбиновую кислоту в дегидроаскорбиновую ( С6Н606, L 0 75, см. формулу на стр. При рН 6 и выше кажущийся нормальный потенциал становится со временем положительнее, потому что окислитель постепенно исчезает из системы. [15]
Страницы: 1