Первый потенциал - ионизация
Cтраница 1
Первые потенциалы ионизации в этой подгруппе также близки по величине и приблизительно в полтора раза выше соответствующей величины для щелочноземельного элемента того же периода. Таким образом элементы этой подгруппы по-прежнему имеют одинаковые орбитальные заселенности, но на этот раз валентные электроны удаляются с трудом. Эти элементы похожи друг надруга, несовершенно отличны от щелочноземельных металлов. [1]
Первый потенциал ионизации Не равен 0 90355 ат. [2]
Первый потенциал ионизации равен 10 48 эВ, электроотрицательность 2 06, ковалентный радиус 0 11 нм. Фосфор образует преимущественно ковалентные связи. [3]
Первый потенциал ионизации Не равен 0 90355 ат. [4]
Первый потенциал ионизации бора, 8 296 эв, довольно высок, а следующие два еще выше. Поэтому общая энергия, требуемая для получения ионов В3, гораздо больше, чем можно было бы скомпенсировать энергией решетки ионных соединений или гидратацией таких ионов в растворе. Следовательно, простая потеря электрона с образованием катиона не играет никакой роли в химии бора. Вместо этого решающее значение имеет образование ковалентной связи, ввиду чего соединения бора по своим свойствам и реакциям обычно похожи на соединения других неметаллов, особенно кремния. [5]
 |
Строение электронной оболочки невозбужденного атома хлора. [6] |
Первый потенциал ионизации фтора очень велик, и это характеризует фтор как неметалл. Электронное сродство фтора также относительно велико, хотя и несколько меньше, чем сродство к электрону у атома хлора. [7]
Первый потенциал ионизации атома показывает значение энергии, необходимой для отрыва одного из его периферийных электронов. Кривая зависимости первого потенциала ионизации от порядкового номера элемента имеет явно выраженный периодический характер. Минимальным потенциалом ионизации ( 3 - 5 эв) обладают щелочные металлы, у атомов которых во внешней оболочке имеется всего лишь один электрон. [8]
Первый потенциал ионизации цезия является минимальным потенциалом ионизации, измеренным для элемента периодической системы. [9]
Первый потенциал ионизации диметилртути имеет величину 9 33 эВ, а метилмеркурхлорида 10 88 эВ, т.е. значительно выше. [10]
Первый потенциал ионизации CHsHgl ( 9 25 эВ) связан с неподеленными парами электронов атома иода, поэтому в реакции с АсОН сначала образуется субстрат, протониров энный по иоду, CHsHglH 1, который затем претерпевает внутримолекулярное превращение типа S &, показанное на схеме. Эта схема подтверждается наличием общего кислотного катализа ( гл. [11]
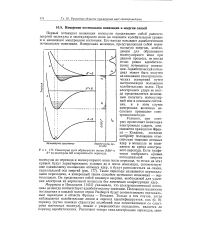 |
Некоторые пути образования ионов ( АВ и А из молекулы АВ и вероятности перехода. [12] |
Первый потенциал ионизации молекулы представляет собой разность энергий молекулы и молекулярного иона на основном колебательном уровне и в наинизшем электронном состоянии. Его иногда называют адиабатическим потенциалом ионизации. Измеренная величина, представляющая собой минимальную энергию, необходимую для образования молекулярного иона при данном процессе, не всегда точно равна адиабатическому потенциалу ионизации. Адиабатический потенциал может быть получен на основании спектроскопических измерений путем экстраполяции положения колебательных полос. При электронном ударе не всегда представляется возможным получить молекулярный ион в основном состоянии, и в этом случае измеренная величина несколько превышает спектроскопическую. [13]
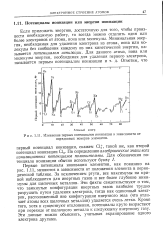 |
Изменение первых потенциалов ионизации в зависимости от порядковых номеров элементов. [14] |
Первые потенциалы ионизации элементов, как показано на рис. 1.11, меняются в зависимости от положения элемента в периодической таблице. За исключением ртути, все максимумы на кривой наблюдаются для инертных газов и все более глубокие минимумы для щелочных металлов. Эти факты свидетельствуют о том, что замкнутые конфигурации инертных газов наиболее трудно разрушить путем удаления электрона, тогда как одиночный электрон, расположенный вне конфигурации инертного газа ( что отличает атомы всех щелочных металлов) удаляется очень легко. Кроме того, хотя и существуют отклонения, потенциалы круто возрастают при переходе от щелочного металла к следующему инертному газу. Эти данные можно объяснить, учитывая экранирование одного электрона другими. [15]
Страницы: 1 2 3 4