Равновесный потенциал - медь
Cтраница 1
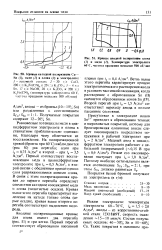 |
Кривые катодной поляризации Си - Sn ( /, медн ( 2 и олова ( 3 в электролите.| Кривые анодной поляризация олова ( / и меди ( 2. Температура электролита 60 С, частота крашения мешалки 500 обмин. [1] |
Равновесные потенциалы меди в циа-нидферратном электролите и олова в станнатном приблизительно одинаковы, благодаря чему облегчается их восстановление. Первый соотвегствует восстановлению меди в цианидферратном электролите при / к 0 5 А / дм2, а второй связан с обеднением прикатодного слоя разряжающимися ионами олова. Кривая выше этого перегиба характеризует выделение на катоде только олова ( серые осадки), кривая выше второго перегиба соответствует выделению водорода. [2]
Равновесный потенциал меди в 0 1 М растворе комплексного цианида меди, содержащем избыток цианистого калия, равен - 1 0 в, объяснить, почему при действии раствора цианистого калия с рН11 на металлическую медь выделяется газообразный водород. [3]
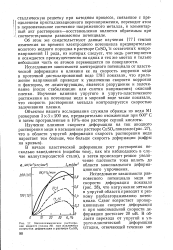 |
Механохимическое растворение медного сплава Ml при различных скоростях деформации в растворе CuSO4. [4] |
Исследование зависимости равновесного потенциала меди от скорости деформации показало ( рис. 28), что нагружение металла в упругой областц приводит к резкому разблагораживанию потенциала. [5]
В связи с этим равновесный потенциал меди в цианидных растворах значительно ( на 1 В и более) сдвинут в сторону электроотрицательных значений. [6]
В связи с этим равновесный потенциал меди в цианистых растворах значительно ( на 1 В и больше) сдвинут в сторону электроотрицательных значений. Выход металла по току в цианистых электролитах меньше, чем в кислых растворах и в отличие от последних резко снижается с повышением плотности тока. Это, а также высокая катодная поляризуемость, обеспечивают хорошую равномерность распределения металла по катодной поверхности, которая тем лучше, чем больше концентрация свободного цианида и меньше содержание меди в растворе. Вследствие высокой катодной поляризации осадки меди из цианистых растворов имеют мелкозернистую структуру, особенно при повышенной концентрации свободного цианида. [7]
В связи с этим равновесный потенциал меди в цианидных растворах значительно ( на 1 В и более) сдвинут в сторону электроотрицательных значений. [8]
Как следует из табл. VI3, равновесный потенциал меди фр для всех выбранных электролитов положительнее потенциала устойчивости железа. [9]
Это происходит потому, что в таких растворах равновесные потенциалы меди при протекании реакций ( 2) и ( 4) одинаковы. В частности, если [ Си2 ] 1 г-ион / л, а [ Си ] 0 001087 г-ион / л, равновесный потенциал разряда обоих ионов Фр 0 345 В. [10]
Как видно из сопоставления кривых на рис. 84, равновесный потенциал меди равен 0 308 в, а мышьяка - 0 17 в. Переход мышьяка в катодный осадок возможен только при 25 и высокой плотности тока. При 50 такой переход маловероятен. [11]
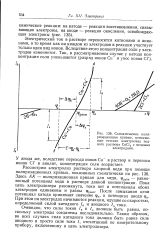 |
Схематические поляризационные кривые, поясняющие течение электролиза водного раствора СиС12 с медными электродами. [12] |
Здесь АК - поляризационная кривая для меди, фравн - равновесный потенциал меди в растворе данной концентрации. Пока цепь электролизера разомкнута, тока нет и потенциалы обоих электродов одинаковы и равны Фравн. После замыкания цепи потенциал катода принимает значение фк, а потенциал анода фа. При этом на электродах начинаются реакции, идущие со скоростью, определяемой силой катодного / к и анодного / а тока. [13]
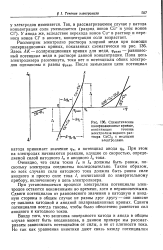 |
Схематические поляризационные кривые, поясняющие течение электролиза водного раствора СиС12 с медными электродами. [14] |
Здесь Л / С - поляризационная кривая для меди, фравн - равновесный потенциал меди в растворе данной концентрации. [15]
Страницы: 1 2