Электродный потенциал - данный металл
Cтраница 1
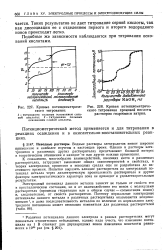 |
Кривые потенциометриче-ского титрования.| Кривая потенциометриче. [1] |
Электродный потенциал данного металла зависит не только от свойств его в кристаллическом состоянии, но и от взаимодействия его ионов с молекулами растворителя ( процессы гидратации или в общем случае - сольватации ионов) и, следовательно, от свойств растворителя. [2]
 |
Одна из схем стандартного водородного электрода. [3] |
Для определения электродного потенциала данного металла составляют гальванический элемент: одним из полуэлементов берут испытуемый металл, погруженный в раствор его соли при стандартных условиях ( ам 1 моль / л, 298 К), вторым полуэлементом - стандартный водородный электрод. [4]
 |
Ряд металлов и сплавов в порядке повышения их потенциала коррозии EKOf в морской воде. [5] |
Пассивное состояние нержавеющей стали обычно соответствует установлению электродного потенциала данного металла в условиях быстрого движения аэрируемой морской воды; активное состояние металла - в слабо аэрируемой, застойной зоне морской воды. [6]
В этой таблице пассивное состояние нержавеющей стали обычно соответствует установлению электродного потенциала данного металла в условиях быстрого движения хорошо аэрируемой морской воды; наоборот, активное состояние соответствует установлению потенциала данного металла в слабо аэрируемой, застойной зоне морской воды. [7]
Следовательно, при уменьшении концентрации ионов металла в растворе алгебраическая величина электродного потенциала данного металла уменьшается. Очевидно, при увеличении концентрации ионов металла в растворе алгебраическая величина электродного потенциала увеличивается. [8]
 |
Схема двойного слоя на поверхности металла в электролите. [9] |
Двойной слой, образующийся на границе между металлом и электролитом, определяет величину электродного потенциала данного металла. [10]
 |
Ряд напряжений. [11] |
Зная нормальные электродные потенциалы Е, нетрудно, пользуясь уравнением ( XIII, 12), рассчитать и электродные потенциалы данного металла в растворах любых концентраций, если для них известна активность электролита в растворе или раствор настолько разбавлен, что можно пользоваться концентрациями вместо активностей. [12]
 |
Нормальные ( стандартные электродные потенциалы Е ( в В в воде при 25 С ( ряд напряжений. [13] |
Зная нормальные электродные потенциалы Е, нетрудно, пользуясь уравнением ( XV, 9), рассчитать и электродные потенциалы данного металла в растворах любых концентраций, если для них известна активность электролита в растворе или раствор настолько разбавлен, что можно пользоваться концентрациями вместо активностей. [14]
 |
Рад яапряж ний. [15] |
Страницы: 1 2