Электродный потенциал - окислитель
Cтраница 1
Электродные потенциалы окислителей и восстановителей определяют с помощью созданных на их основе гальванических элементов. [1]
Поэтому электродный потенциал окислителя падает, а восстановителя возрастает. Когда потенциалы обоих процессов станут равны друг другу, реакция оканчивается - наступает химическое равновесие. [2]
При протекании той или иной окислительно-восстановительной реакции концентрация исходных веществ уменьшается. Поэтому электродный потенциал окислителя падает, а восстановителя возрастает. Когда потенциалы обоих процессов станут равны друг другу, реакция оканчивается - наступает химическое равновесие. [3]
 |
Ряд напряжений металлов. [4] |
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакцида - возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается - наступает состояние химического равновесия. [5]
 |
Ряд напряжений металлов. [6] |
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции - возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается-наступает состояние химического равновесия. [7]
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции - возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается - наступает состояние химического равновесия. [8]
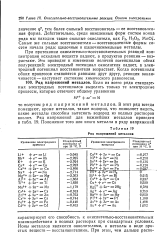 |
Ряд напряжений металлов. [9] |
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции - воз растают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается - наступает состояние химического равновесия. [10]
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции - возрастают. Это приводит к изменению величин потенциалов обеих лолуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается - наступает состояние химического равновесия. [11]
 |
Ряд напряжений металлов. [12] |
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции - возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а эл ек-тродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция закан-чива. [13]
 |
Ряд напряжений металлов. [14] |
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции - возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается - наступает состояние химического равновесия. [15]
Страницы: 1 2