Электродный потенциал - система
Cтраница 1
Электродный потенциал системы Ti3 H2O ТЮ1 2Н е - равен 0 10 В. [1]
Электродный потенциал системы окислителя стал больше, чем у системы восстановителя, поэтому в этих условиях К2Сг2О7 окисляет соляную кислоту до свободного хлора. [2]
Изменение электродных потенциалов системы от рН раствора можно исследовать, применяя для измерения рН - метр со стеклянным электродом. [3]
Как зависит от величины электродного потенциала системы процесс восстановления ее ОФ и окисления ВФ. [4]
За счет образования малодиссоциированного комплексного иона электродный потенциал системы Си 2С1 - - е - [ СиС12 ] - сдвигается в область отрицательных значений так, что оказывается возможным окисление меди ионом водорода. [5]
Поэтому в ряду Fe - Ru - Os Еодожнтельнее значение электродного потенциала системы М2 / М увеличивается, химическая активность простых веществ в растворе уменьшается. [6]
Стандартный электродный потенциал системы ( 1) равен - 2 71В Электродный потенциал системы ( 2) зависит от рН и в нейтральной среде имеет значение - 0 41 В. [7]
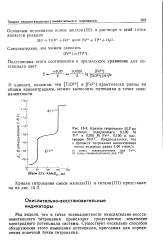 |
Кривые титрования 50 0 мл раствора, содержащего 0 100 М Ti3 и 0 200 М Fe2, 0 100 н. раствором МпО. Предполагается, что в процессе титрования концентрация ионов водорода равна 1 00 гнион / л. [8] |
Мы видели, что в точке эквивалентности окислительно-восстановительного титрования происходит существенное изменение электродного потенциала системы. Существует несколько способов обнаружения этого изменения потенциала, пригодных для определения конечной точки титрования. [9]
Характерные особенности поведения пассивирующихся коррозионных систем определяются необычностью изменения скорости анодного процесса с изменением электродного потенциала системы. [10]
Другой важной особенностью роста коррозионных трещин является то обстоятельство, что состав ( в частности водородный показатель среды рН) и электродный потенциал системы металл - среда в трещине и на гладкой поверхности значительно отличаются. А поскольку наряду с коэффициентом интенсивности напряжений скорость роста трещины определяется электрохимической ситуацией в вершине трещины, то представляется особенно важным ее изучение. [11]
Другой важной особенностью роста коррозионных трещин является то обстоятельство, что состав ( в частности водородный показатель среды рН) и электродный потенциал системы металл - среда в трещине и на гладкой поверхности значительно отличаются. А поскольку наряду с коэффициентом интенсивностп напряжений скорость роста трещины определяется электрохимической ситуацией в вершнне трещины, то представляется особенно важным ее изучение. [12]
Другой важной особенностью роста коррозионных трещин является то обстоятельство, что состав ( в частности, водородный показатель среды рН) н электродный потенциал системы металл - среда в трещине и на гладкой поверхности Значительно отличаются. А поскольку наряду с коэффициентом интенсивности напряжений скорость роста трещины определяется электрохимической ситуацией в вершпне трещины, то представляется особенно важным ее изучение. [13]
Другой важной особенностью роста коррозионных трещин является то обстоятельство, что состав ( в частности, водородный показатель среды рН) и электродный потенциал системы металл-среда в трещине и на гладкой поверхности значительно различаются. [14]
Другой важной особенностью роста коррозионных трещин является то обстоятельство, что состав ( в частности, водородный показатель среды рН) и электродный потенциал системы металл - среда в трещине и на гладкой поверхности Значительно отличаются. А поскольку наряду с коэффициентом интенсивности напряжений скорость роста трещины определяется электрохимической ситуацией в вершцне трещины, то представляется особенно важным ее изучение. [15]
Страницы: 1 2