Электродный потенциал - система
Cтраница 2
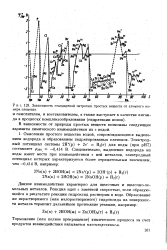 |
Зависимость стандартной энтропии простых веществ от атомного номера элемента. [16] |
Электродный потенциал системы 2Н ( р) 2е - Н2 ( г) для воды ( при рН7) составляет 98 - - 0 414 В. [17]
Электродный потенциал системы 2Н ( р) 2е - Н2 ( г) для воды ( при рН 7) составляет Ет - 0 414 В. [18]
Электродный потенциал системы 2Н ( р) 2е - Н2 ( г) для воды ( при рН 7) составляет E g - 0 414 В. [19]
По физическим свойствам он скорее напоминает соседние элементы по периодической системе - таллий, свинец и висмут, чем непосредственный гомолог - теллур. Электродный потенциал системы Ро - Ро ( IV) равен 0 76 в, потенциал системы Ро - Ро ( II) не поддается измерению вследствие окисления низшего валентного состояния под действием а-излучения. [20]
В соответствии со строением электронных оболочек ионов Ей, Yb и Sm обладают способностью при восстановлении образовывать промежуточное состояние с валентностью 2, в отличие от остальных рзэ, которые восстанавливаются, по-видимому, сразу до металлического состояния. Оценивать такую способность обычно принято электродным потенциалом системы, в данном случае Ln3 / Ln2, при условии полной ее обратимости. В табл. 30 приведены главным образом потенциалы полуволн при полярографическом восстановлении на ртутном катоде и лишь два значения стандартного потенциала, полученные классическим способом. В пределах ошибок определений они совпадают, что наблюдается редко, но теоретически вполне возможно. [21]
Существуют несколько модификаций таких красок, общее для них - приготовление суспензии в жидком стекле порошка металлического цинка, который обеспечивает преимущественный механизм протекторной ( электрохимической) защиты стали от коррозии. При попадании цинксиликатного покрытия в коррозионную среду сразу же устанавливается электродный потенциал системы, равный потенциалу цинка. Защита осуществляется благодаря катодной поляризации, полностью подавляющей локальный ток коррозии подложки. Электрохимическая защита уже в первом периоде обеспечивается меньшим током благодаря наличию на подложке ряда химических соединений, являющихся пассиватора-ми ( ингибиторами) коррозии, как например СаСО3, Na2O - nSiO2, NaOH, Fe2SiO4, Zn ( OH2 и др. Вследствие поляризационных явлений и роста омического сопротивления пары Zn ( A) - Ре ( ю Р ль электрохимического фактора в защитном эффекте уменьшается. Во втором периоде [29], когда потенциал системы становится положительнее потенциала анодных участков подложки, превалирующую роль начинает играть ингибирующий эффект защитного слоя, сформированного в первом периоде. [22]
Чистые металлы семейства железа прочные и пластичные. На эти свойства сильно влияют загрязнения. Соответственно их положению электродные потенциалы систем Э / Э 2 равны - 0 441, - 0 277 и - 0 250 В. [23]
Отсутствие Зо5 - элект-рона у иона титана ( 1У) изменяет энергетическое состояние Зс. Об этом свидетельствуют значения электродных потенциалов системы титан ( 1У) / титан ( Ш) в присутствии о-фенантролина и а а - дипиридила ( табл. 2), которые показывают, что величины констант нестойкости соединений титана ( Ш) с этими лигандами гораздо ниже, чем у соединений тита-на ( 1У), и, следовательно эти лиганды стаоилизируют титан в степени окисления три. [24]
Окисление простых веществ за счет выделения водорода в растворах кислот протекает активнее, чем в чистой воде. Повышение концентрации ионов ОНз отвечает уменьшению отрицательного значения электродного потенциала системы Н ( р) е - V2H2 ( r), поэтому число металлов. [25]
Окисление простых веществ за счет выделения водорода в растворах кислот протекает активнее, чем в чистой воде. Повышение концентрации ионов OHJ отвечает уменьшению отрицательного значения электродного потенциала системы Н ( р) е - 1 / 2Н3 ( г), поэтому число металлов, взаимодействующих по этому механизму, резко увеличивается. [26]
Окисление простых веществ за счет выделения водорода в растворах кислот протекает активнее, чем в чистой воде. Повышение концентрации ионов ОНз отвечает уменьшению отрицательного значения электродного потенциала системы Н ( р) е - - V2H2 ( r), поэтому число металлов, взаимодействующих по этому механизму, резко увеличивается. [27]
Аналогично тому, что наблюдалось и в реакциях других типов, изменение функции по ординате вблизи точки эквивалентности становится заметнее, поскольку увеличивается полнота протекания реакции. На рис. 15 - 2 представлены результаты титрования гипотетического определяемого вещества А со стандартным потенциалом 0 2 В различными реагентами, имеющими стандартные потенциалы от 0 4 до 1 2 В; соответствующие константы равновесия реакции ( гл. Ясно, что с увеличением полноты протекания реакции электродный потенциал системы увеличивается. [28]
Сжатие атомов лантаноидов влечет за собой увеличение потенциалов ионизации и уменьшение активности. Металлы, стоящие непосредственно за лантаноидами, благодаря сжатию имеют сильно пониженную активность, часто меньшую, чем у стоящих над ними. Это приводит к тому, что в побочных подгруппах, кроме подгруппы IIIB, радиусы атомов элементов 6-го периода оказываются почти такими же, как и радиусы атомов элементов 5-го периода той же подгруппы. В побочных подгруппах ( кроме IIIB) активность металлов обычно растет снизу вверх, а не сверху вниз, как в главных подгруппах. Например, первые потенциалы ионизации никеля, палладия и платины соответственно 7 63; 8 33 и 9 00 В, а электродные потенциалы систем Ме / Ме2 - 0 25; 0 987 и 1 2 В. [29]
Страницы: 1 2