Обратимый электродный потенциал
Cтраница 1
Обратимые электродные потенциалы распространяются на ограниченное число случаев взаимодействия металла с электролитом, содержащим только ионы этого металла. [1]
 |
Зависимость величины ДЕ от, состава Zn, Си-сплавов при концентрации CuSO4, равной 2 34 - Ю-2 М. [2] |
Термодинамическая теория обратимых электродных потенциалов на сплавах, изложенная в разделе 1.3, подобного потенциала не вводила: система сплав-раствор там анализировалась без учета каких-либо обогащенных зон. [3]
 |
Влияние молекулярных веществ ( в, поверхностно активных анионов ( а и катионов ( б на электрокапиллярную кривую ртути в растворе КМОа. [4] |
В табл. 25 приведены обратимые электродные потенциалы, представляющие наибольший интерес для коррозионных процессов и исследований. [5]
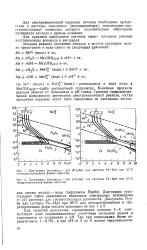 |
Диаграмма потенциал - рН ( Пурбе для системы Fe - Н2О при 25 С ( негидратированная форма окислов.| Диаграмма потенциал - рН ( Пурбе для системы Fe - Н2О при 25 С ( гидратированная форма окислов. [6] |
Диаграммы представляют собой зависимости обратимых электродных потенциалов от рН раствора для соответствующих равновесий. [7]
Для многих органических электродных процессов обратимый электродный потенциал, а также коэффициенты активности, необходимые для расчета величины Е, неизвестны. [8]
На этих диаграммах представлена зависимость обратимых электродных потенциалов от рН раствора. Оказалось, что возникновение сульфидов той или иной структуры на корродирующей поверхности металла тесно связано с условиями протекания коррозионного процесса. Вместе с тем установлено определенное влияние продуктов сероводородной коррозии на кинетику процесса растворения металла. [9]
Если потенциал выделения отличается от термодинамического обратимого электродного потенциала, то имеет место перенапряжение. [10]
По меньшей мере приближенное значение стандартного обратимого электродного потенциала можно получить при измерении потенциала полярографической полуволны, если другие способы получения термодинамических характеристик неприменимы. Этот метод применим для проверки стандартного электродного потенциала, вычисленного по известным данным для свободной энергии. [11]
Различие между напряжением разложения и разностью термодинамически обратимых электродных потенциалов объясняется перенапряжением на электродах при плотности тока, близкой к нулю. [12]
Только при соответствии всех этих величин может устанавливаться Обратимый электродный потенциал, означающий равновесие фаз. При нарушении же этого соответствия развиваются электрохимические реакции, которые в конечном счете восстанавливают равновесие. Частным случаем таких превращений может быть СР одного из компонентов ( чаще всего электроотрицательного), приводящее к изменению количественного состава или даже, полному распаду сплава. [13]
Строение двойного электрического слоя не имеет значения для величины обратимого электродного потенциала, которая определяется изменением изобарно-изотермического потенциала соответствующей электрохимической реакции. [14]
Для проведения процесса электролиза с конечной силой тока, помимо термодинамически обратимых электродных потенциалов и перенапряжения, необходимо преодолеть потери напряжения из-за омических сопротивлений по пути тока через ячейку и дополнительных явлений концентрационной поляризации, возникающей вследствие изменений концентрации электролита в ходе электролиза. [15]
Страницы: 1 2 3