Положительный электродный потенциал
Cтраница 1
Положительный электродный потенциал означает, что окислитель Ох сильнее, чем ионы водорода, тогда как отрицательный потенциал говорит о том, что восстановитель Red сильнее водорода. В табл. 31 приводится выборочная сводка стандартных электродных потенциалов. [1]
Положительный электродный потенциал означает, что данный окислитель имеет более сильные окислительные свойства, чем ионы водорода. Отрицательный потенциал показывает, что восстановитель имеет более сильные восстановительные свойства, чем водород. [2]
Положительный электродный потенциал меди сильно раз-благораживается за счет перемешивания электролита или при добавлении в раствор комплексообразователей, таких, как аммиак, аммиачные соли, цианистый калий и др. При доступе кислорода воздуха при этом образуются комплексные ионы [ Cu ( NH3) 4 ] 2 и [ Cu ( CN) 4l2 -, что усиливает коррозию меди. [3]
Положительный электродный потенциал меди сильно раз-благораживается за счет перемешивания электролита или при добавлении в раствор комплексообразователей, таких, как аммиак, аммиачные соли, цианистый калий и др. При доступе кислорода воздуха при этом образуются комплексные ионы [ Cu ( NH t) 4 ] 2 и [ Cu ( CN) 4 ] 2 -, что усиливает коррозию меди. [4]
Ртуть имеет положительный электродный потенциал, а потому окисляться ионами Н воды не может. [5]
Ртуть имеет положительный электродный потенциал, поэтому не вытесняет водорода ни из воды, ни из кислот. [6]
Ртуть имеет положительный электродный потенциал, поэтому не вытесняет водород ни из воды, ни из кислот. [7]
Катодные покрытия, имеющие более положительный электродный потенциал, чем потенциал углеродистой стали, защищают сталь только механически, пока покрытие сплошное. Из таких покрытий представляют интерес никелевые, хромовые и свинцовые покрытия. Никелевые покрытия обладают стойкостью в щелочных средах и нашли применение для защиты ванн при электролизе воды. Никелевые и хромовые покрытия служат также хорошей защитой от атмосферной коррозии. [8]
В ряду напряжений медь обладает положительным электродным потенциалом и, как правило, корродирует с кислородной деполяризацией. Медь и ее сплавы нестойки в азотной кислоте, концентрированной серной кислоте, аэрированных неокисляющих кислотах и вообще в окислительных средах ( например, в растворах FeCl3) - Зато эти материалы стойки при действии на них фосфорной, соляной, уксусной и разбавленной серной кислот, в которых не содержится растворенный воздух. Они также проявляют высокую коррозионную стойкость в водных растворах щелочей. [9]
В ряду напряжений медь обладает положительным электродным потенциалом и, как правило, корродирует с кислородной деполяризацией. Зато эти материалы стойки при действии на них фосфорной, соляной, уксусной и разбавленной серной кислот, в которых не содержится растворенный воздух. Они также проявляют высокую коррозионную стойкость в водных растворах щелочей. [10]
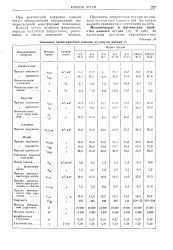 |
Основные характеристики ковкого чугуна по маркам. [11] |
При контактной коррозии ковкий чугун обнаруживает пониженный, положительный электродный потенциал. [12]
Другой участок поверхности металла, который имеет более положительный электродный потенциал, в контакте с электролитом становится катодом. Например, при наличии кислот в электролите на катодном участке металла ионы водорода поглощают избыток электронов и тем самым разряжаются, превращаясь в атомы водорода. Атомы водорода, соединяясь друг с другом, могут образовывать молекулы водорода, а они в виде пузырьков газа выделяются из раствора. Однако, атомарный водород может образовывать оболочку на поверхности катода, и эта оболочка тормозит коррозионный процесс вплоть до его прекращения. Образование оболочки - пленки водорода называют поляризацией. Обратный процесс - разрушение водородной пленки, связанный с удалением водорода с поверхности катода, называют деполяризацией, а вещества, способные связывать и удалять водород, называют деполяризаторами. [13]
Другой участок поверхности металла, который имеет более положительный электродный потенциал, в контакте с электролитом становится катодом. На катоде происходит, ассимиляция тех электронов, которые освободились на анодном участке металла. Например, при наличии кислот в электролите на катодном участке металла ионы водорода поглощают избыток электронов и тем самым разряжаются, превращаясь в атомы водорода. Атомы водорода, соединяясь друг с другом, могут образовывать молекулы водорода, а они в виде пузырьков газа выделяются из раствора. Однако, атомарный водород может образовывать оболочку на поверхности катода, и эта оболочка тормозит коррозионный процесс вплоть до его прекращения. Образование оболочки - пленки водорода называют поляризацией. Обратный процесс - разрушение водородной пленки, связанный с удалением водорода с поверхности катода, называют деполяризацией, а вещества, способные связывать и удалять водород, называют деполяризаторами. [14]
Легче всего восстанавливаются на катоде ионы металла с наиболее положительным электродным потенциалом. [15]
Страницы: 1 2 3 4