Положительный электродный потенциал
Cтраница 2
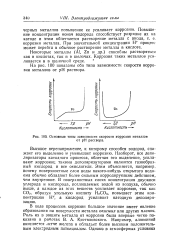 |
Основные типы зависимости скорости коррозии металлов от рН раствора. [16] |
Например, алюминий окисляется легче железа и обладает более высоким положительным электродным потенциалом. [17]
Например, алюминий окисляется легче железа и обладает более высоким положительным электродным потенциалом. Однако практически он более устойчив, чем железо, в атмосферных условиях, так как, окисляясь кислородом воздуха, покрывается компактной пленкой окиси. Пленка, изолируя поверхность металла от соприкосновения с воздухом, прекращает дальнейшее взаимодействие. В этих случаях толщина пленки достигает 50 - 100 А и более, при этом меняется внешний вид металла, он теряет свой металлический блеск. Однако весьма часто подобную же роль играют и более тонкие пленки, не изменяющие заметно внешнего вида металла. [18]
Коррозия Ti в средах разной агрессивности протекает при более положительных электродных потенциалах, чем его собственный стандартный потенциал. Это означает, что происходит анодное торможение коррозионного процесса. В случае, когда поверхность металла находится в активном состоянии, процесс растворения Ti может замедляться вследствие образования на поверхности оксидов и гидридов. [19]
При контактной коррозии ковкий чугун обнаруживает пониженный, но положительный электродный потенциал. [20]
Катодные участки ( катоды) обладают менее отрицательными или более положительными электродными потенциалами в данных условиях. [21]
Заменив в рассмотренном элементе водородный электрод каким-либо другим электродом, имеющим более положительный электродный потенциал, чем электрод Fe2, aq; Fe3, aq Fe, можно составить химический элемент, при. [22]
Как было показано, контакт алюминиевых сплавов с металлами, имеющими более положительные электродные потенциалы, неблагоприятно сказывается на коррозионной стойкости этих сплавов в электролитах. Опыт эксплуатации ЛБТ показывает, что / бурильные трубы из алюминиевых сплавов значительно сильнее поражаются коррозией в зоне контакта со стальными замками, чем на остальной части поверхности трубы. При этом контактная коррозия особенно интенсивно развивается с наружной стороны трубы. На внутренних стенках ЛБТ вблизи от мест соединения их с замками аналогичного явления обычно не наблюдается. [23]
Электролитическим путем из водных растворов могут выделяться не только металлы с положительным электродным потенциалом по отношению к водороду, но и металлы с отрицательным электродным потенциалом, на которых водородное перенапряжение достаточно высоко. В частности, электролизом водных растворов могут быть получены медь, серебро, золото, платановые металлы, цинк, кадмии, галлий, индий, таллий, олово, свинец, сурьма, висмут, хром, марганец, железо, кобальт, никель. [24]
Не следует полагать, что в концентрационном элементе анод цепи обязательно имеет положительный электродный потенциал по отношению к нормальному водородному электроду, а катод - отрицательный. [25]
Базовый потенциал ( base potential) - потенциал, отнесенный к самому положительному электродному потенциалу ряда напряжений. [26]
Электроннопроводящие породы ( сульфиды, графит, антрацит и др.) характеризуются положительными электродными потенциалами. Наилучшие результаты дает МЭП при использовании цинковых электродов. Цинк ( Z73n - 0 76 В) характеризуется быстрым формированием электродного потенциала, величина которого мало зависит от ионного состава электролитов и стабильна во времени при перемещении электродов по скважине. [27]
Можно применять покрытие оловом методом напыления, но поскольку олово является металлом с положительным электродным потенциалом, поры на покрытии следует уплотнить глянцеванием во избежание коррозии основного металла. [28]
Как показали результаты исследований, швы, выполненные электродами с рутиловым покрытием, имеют более положительный электродный потенциал, чем основной металл ( это объясняется микролегированием шва титаном, который присутствует в обмазке покрытия), а выполненные электродами с основным покрытием - более отрицательнйгй. Такие швы булут анодами и подвергаются коррозии. [29]
Участок с меньшим электродным потенциалом в контакте с электролитом становится анодом, а с более положительным электродным потенциалом - катодом. На аноде ионы металла из кристаллической решетки переходят в электролит в виде гидратированных положительно заряженных ионов, при этом образуются свободные избыточные электроны, остающиеся на анодных участках. [30]
Страницы: 1 2 3 4