Равновесный электродный потенциал
Cтраница 2
Величина равновесного электродного потенциала данного металла зависит от концентрации его ионов в растворе. [16]
 |
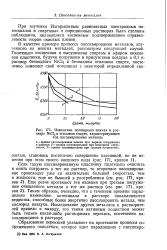
Зависимость перенапряжения водорода т ] от порядкового номера элемента для трех больших периодов ( 0 1 - 2 н. раствор НС1 или HaSO-i, плотность тока - 1 а / см2, температура - 20 - 29 С. [17] |
Скорость установления равновесного электродного потенциала и чувствительность его к различным нарушениям характеризуются величиной тока обмена. [18]
Что называется равновесным электродным потенциалом. [19]
Таким образом, равновесный электродный потенциал зависит от свойств ионов, определяющих его, и от их концентрации в растворе. Зависимость потенциала электрода от концентрации потенциалопределяющих ионов в растворе электролита предложена В. [20]
Таким образом, равновесный электродный потенциал зависит от свойств ионов и их концентрации в растворе. Зависимость потенциала электрода от концентрации потенциалопределяющих ионов в растворе электролита предложена В. [21]
Такое незначительное изменение равновесных электродных потенциалов в целом не должно существенно изменить кинетику коррозионных процессов. [22]
Такое незначительное изменение равновесных электродных потенциалов, учитывая также, что последние далеко не всегда однозначно характеризуют скорость коррозии, позволяет полагать, что влияние напряжений в металле на ускорение равномерной коррозии лишь в малой степени определяется уменьшением термодинамической стабильности металла. Нарушение сплошности пленок при деформации металла или возникновение менее совершенных защитных пленок на деформированных поверхностях, может гораздо в большей степени влиять на установление скорости коррозионного процесса. [23]
 |
Изменение потенциала никеля в растворе NiCl2 в этиловом спирте, характеризующее ход пассивирования металла. [24] |
При изучении Изгарышевым равновесных электродных потенциалов в спиртовых и пиридиновых растворах были сделаны наблюдения, являющиеся косвенным подтверждением справедливости теории окисных пленок. [25]
Рассчитанные величины изменения равновесного электродного потенциала металла при приложении растягивающих напряжений в области упругих деформаций невелики - не превышают нескольких милливольт. Следует иметь в виду, что в местах концентрации напряжений и локализации механических деформаций смещение электродного потенциала при приложении растягивающих напряжений может достигать нескольких десятков милливольт. [26]
По полученным значениям равновесного электродного потенциала амальгамы кадмия Е строят график в координатах Е - gci -, находят тангенс угла наклона линейного участка, наблюдаемого при наиболее высоких концентрациях иодид-ионов. [27]
Определенный по уравнению (8.67) равновесный электродный потенциал можно понимать как результат перехода ионов или электронов в обоих направлениях через границу раздела фаз. Равновесие и, соответственно, равновесный потенциал фравн достигаются, когда скорость перехода в обоих направлениях становится одинаковой. Если через электрод протекает дополнительный ток ( электролиз или отвод тока от гальванической ячейки), то равновесие нарушается и устанавливается потенциал фь зависящий от плотности тока. [28]
 |
Цепь для измерения электродного потенциала. [29] |
Поэтому электродные потенциалы часто называют равновесными электродными потенциалами или просто равновесными потенциалами. [30]
Страницы: 1 2 3 4