Неравновесный потенциал
Cтраница 1
Неравновесные потенциалы в практических условиях приходится определять опытным путем. [1]
Неравновесные потенциалы называются нестационарными, если они не устанавливаются на определенном значении во времени. [2]
Значение неравновесного потенциала находят экспериментально. [3]
Для неравновесных потенциалов формула Нернста непосредственно уже не применима, поскольку она выведена для условий равновесия металла с собственными ионами. [4]
Теория неравновесных потенциалов, разработанная Луковцевым для реальных окисных электродов, обобщает факторы, влияющие на устойчивость окислов никеля и потенциал ОНЭ. Неравновесность потенциалов окисных электродов связана также с необратимым взаимодействием с кислородом воздуха вследствие протекания реакции ионизации кислорода на поверхности электрода, потенциал которого ниже потенциала обратимого кислородного электрода. [5]
На изменение величины неравновесных потенциалов с течением времени могут влиять самые разнообразные причины, например температура, движение и изменение состава раствора, состояние поверхности металла и др. Характер и степень их влияния на величину потенциала изучены недостаточно. [6]
Стационарным потенциалом называется постоянный во времени неравновесный потенциал, при котором суммы скоростей анодных и катодных процессов, протекающих на одной поверхности ( растворение и выделение обоих металлов), равны. Выделение микрокомпонента при этом происходит, но очень медленно. [7]
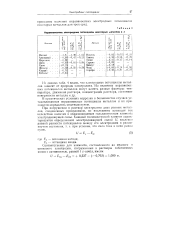 |
Неравновесные электродные потенциалы некоторых металлов в в. [8] |
В практических условиях коррозии в большинстве случаев устанавливаются неравновесные потенциалы металлов и их приходится определять опытным путем. [9]
В табл. 2 в качестве примера приведены значения неравновесных потенциалов некоторых металлов в 3 % - ном растворе NaCl. [10]
В практике борьбы с коррозией наибольшее значение имеют величины неравновесных потенциалов. [11]
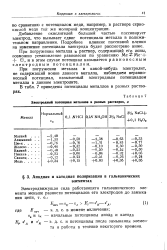 |
Электродный потенциал металлов в разных растворах, в. [12] |
При погружении металла в какой-нибудь электролит, не содержащий ионов данного металла, наблюдаем неравновесный потенциал, называемый электродным потенциалом металла в данном электролите. [13]
Перед проведением работы следует ознакомиться: 1) с равновесными потенциалами, с рядом стандартных потенциалов; 2) с неравновесными потенциалами; 3) с компенсационной схемой измерения электродвижущих сил ( стр. [14]
Уравнение Нернста, выведенное для расчета равновесных потенциалов, а также ряд напряжений, приведенный в табл. 1, неприменимы для неравновесных потенциалов. Величины последних весьма различны в зависимости от природы раствора электролита и заранее рассчитать их невозможно. В каждом отдельном случае неравновесные потенциалы приходится определять опытным путем. [15]
Страницы: 1 2