Замена - алкильная группа
Cтраница 1
Замена алкильной группы не оказывает заметного влияния, причем скорость может как уменьшаться, так и увеличиваться. [1]
Замена алкильных групп в трналкилфосфинах на атомы галогена снижает реакционную способность соединений по отношению к сере. [2]
Замена алкильной группы R [ метильной в ( 65) на аллильную в ( 66) ] незначительно влияет на скорость разложения в газовой фазе, хотя энергии диссоциации для аналогичных связей R - Н различаются на 80 кДж / моль. [3]
При замене алкильных групп в боковых цепях пиридина на алкенильные и алкинильные [560] наблюдаются несколько более высокие значения стабильности молекул к электронному удару. Однако при достаточно длинных ненасыщенных цепях устойчивость молекулярных ионов становится соизмеримой для таковой у алкил-пиридинов. Разветвление ненасыщенного заместителя пиридина в еще более высокой степени сказывается на стабильности, чем в случае алкильных боковых цепей. По-видимому, такое влияние связано с увеличением возможностей протекания перегруппировочных процессов. [4]
Нитрование ароматических соединений сопровождается окислительными превращениями, заменой алкильных групп и атомов галоида нитрссруппами, дезалкилированием простых эфи-ров фенола, окислением алкильных групп. Например, показано, что нитрование бензола приводит частично к образованию дини-трофенола и пикриновой кислоты. [5]
Реакционная способность алкилорганосилилфосфитов в реакции Арбузова увеличивается по мере замены алкильных групп на триорганосилиль-ные группы. [6]
Как видно из приведенных в табл. 11 ( № 5) данных по щелочному гидролизу фторангидридов кислот фосфора, при замене алкильной группы, связанной с фосфором, на алкоксигруппу, константы скорости реакции, как правило, снижаются в десятки раз. Однако изменение констант скоростей реакций, определенных только при одной температуре, естественно, не отражает изменения энергии активации и энтропии реакций нуклеофильного замещения фосфатов и фосфонатов, что затрудняет возможность детального обсуждения электронных эффектов алкокси-и алкильных групп, связанных с фосфором, в переходном состоянии при нуклеофильном замещении у атома фосфора. [7]
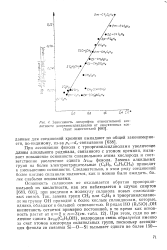 |
Зависимость логарифма относительной кислотности диорганосиландиолов от индуктивных констант заместителей. [8] |
При ассоциации фенола с триорганилсиланолами увеличение длины алкильного радикала, связанного с атомом кремния, вызывает повышение основности силанольного атома кислорода и соответственно увеличение сдвига AVOH фенола. Замена алкильных групп на более электроотрицательные ( C6Hs, C6H5CH2) приводит к уменьшению основности. Следовательно, в этом ряду соединений более кислые силанолы являются, как и можно было ожидать, более слабыми основаниями. [9]
Из данных табл. 16 сразу следуют два вывода. Общее изменение скоростей при замене алкильных групп всегда невелико. [10]
В работе Хадсона и Кея исследован гидролиз диэтил - и метокси-этилхлорфосфонатов и диметоксихлорфосфата. Как видно из этой таблицы, при замене алкильной группы, связанной с фосфором, на алкоксигруппу константа скорости снижается и одновременно повышается энергия активации приблизительно на 1 5 - 2 0 ккал / моль. Этот эффект, по-видимому, может быть объяснен тем, что в переходном состоянии неподеленная пара 2рк - электронов атома кислорода алкоксигруппы смещается на Sd-орбиты атома фосфора. [11]
Скорость присоединения к нитрильной группе растет при замене алкильных групп, связанных с атомом алюминия, элек-троноакцепторными группами ( галогенами, фенильной группой), а также при замене одного алкильного остатка в диалкиламино-группе фенильной группой. Реакционная способность замещенных бензонитрилов увеличивается по мере усиления электроноакцеп-торных свойств заместителя. Следовательно, определяющей стадией данной реакции является нуклеофильное присоединение ди-алкиламиногруппы к атому углерода нитрильной группы. [12]
Поведение первичных аминов при регистрации циклических вольт-амперограмм или в ходе электролиза при контролируемом потен-циале коренным образом отличается от поведения вторичных и третичных аминов. Пики на вольтамперограммах сильно растянуты, хотя также полностью необратимы; потенциалы почти не изменяются при замене алкильной группы. [13]
Замещение фенильных групп другими арильными группами ведет к увеличению вязкости и уменьшению индекса вязкости. Если обобщить данные о влиянии строения алкиларилфосфатов на вязкость, то можно сказать, что увеличение молекулярного веса вызывает увеличение вязкости, а замена алкильных групп нормального строения разветвленными группами приводит к снижению индекса вязкости. Усложнение структуры арильных групп дает увеличение вязкости и уменьшение индекса вязкости. Примерно такие же закономерности наблюдались и в случае ди-алкиларилфосфатов. [14]
Если же ара-положение блокировано, то реакции может не пройти совсем или же принести к. XI), ца ряду с которым присутствуют только следы 2-окси - 3 Д5 - тримстилбенз-альдегида ( XIII); этот пример свидетельствует о том, что стремление к гсара-замещепию является настолько сильным, что замена алкильной группы на альдегидную протекает предпочтительно перед орто-згметением. В таблицах приведено еще несколько других примеров деа л копирования бензольных производных. [15]
Страницы: 1 2