Метальный заместитель
Cтраница 1
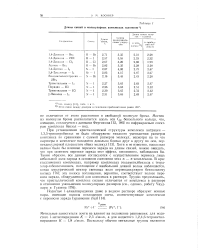 |
Длины связей в молекулярных комплексах галогенов а. [1] |
Метальные заместители почти не влияют на положение равновесия; для йодистого 1-метилпиридиния К 2 3 л / моль, а для йодистого 1 2 4 6-тетраметил-пиридиния К 1 8 л / моль. [2]
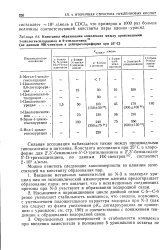 |
Константы образования комплексов между производными. [3] |
Введение метальных заместителей по N-3 в молекуле ура-цила или по экзоциклической аминогруппе аденина предотвращает образование пары; это означает, что в незамещенных соединениях протоны при N-3 участвуют в образовании водородной связи. [4]
Введение метального заместителя в положение 1 или 4 вызывает батохромное смещение этой полосы и небольшое увеличение ее интенсивности. При введении заместителя в положение 2 или 3 в силу стерических затруднений сила осциллятора перехода несколько уменьшается. [5]
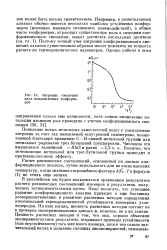 |
Энтропия смешения двух неидентичных конформеров. [6] |
Появление новых метальных заместителей ведет к уменьшению энтропии за счет так называемой внутренней симметрии, возникающей благодаря вращению С - Н - связей метильной группы или метильных радикалов трет. Понятно, что исчезновение метильной или трет. [7]
Блокирующее влияние метальных заместителей, так же как и теоретическое рассмотрение, основанное на концепции энергий локализации, доказывает, что переходное состояние в реакции присоединения затрагивает углеродный атом, а не всю u - электронную систему в целом. Эта точка зрения заслуживает внимания, так как считалось возможным, что переходное состояние в радикальном присоединении представляет собой тс-комп-лекс. [8]
Блокирующее влияние метальных заместителей следует отличать от других пространственных влияний, приводящих к некоторой деформации молекулы. Нужно рассмотреть два типа деформаций. [9]
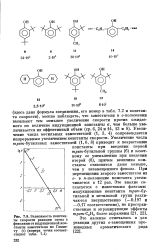 |
Зависимость константы скорости реакции озона с фенолами от индукционной константы заместителя по Гамме-ту ( s ( номера точек соответствуют. [10] |
Увеличение числа метальных заместителей ( 1, 3, 4) сопровождается непрерывным увеличением константы скорости. [11]
В случае метального заместителя это, по-видимому, достаточно оправдано, т.к. вряд ли метил вносит большое возмущение в диеновые Ti-орбитали. Однако очень часто влиянием заместителя пренебречь нельзя. Например, молекула 2-цианобутадиена содержит заместитель CN с сильным ( - Л /) - эффектом, который, конечно, нужно учитывать. [12]
Резонанс протонов аксиального метального заместителя у атопа О6 осуществляется в более слабом поле, чем резонанс протонов экваториального заместителя. [13]
Поскольку отсутствие боковых метальных заместителей у ПАН, по-видимому, способствует более плотной упаковке, то миграция атома водорода может происходить от третичного углеродного атома соседней молекулы, в связи с чем образуется частично сшитая структура, и полимер на первых же стадиях термообработки теряет растворимость. [14]
Отметим, что метальные заместители в положении 1 или 2 или 2 и 6 антрацена не оказывают заметного влияния на реакционную способность. Однако реакционная способность 9-метилантрацена примерно равна половине реакционной способности антрацена, а реакционная способность 9, 10-диметилантрацена очень низка. [15]
Страницы: 1 2 3 4