Элек-тронодонорный заместитель
Cтраница 2
Еще одним важным структурным фактором является введение электронодонорного заместителя. Влияние элек-тронодонорного заместителя на ля - и яя - уровни существенно зависит от расположения его по отношению к группе, ответственной за состояние ля - типа, и к я-си-стеме в целом. [16]
Правила ориентации при алкилировании в общем подобны другим реакциям электрофильного замещения в ароматическое ядро, но строение продукта может существенно изменяться в зависимости от катализаторов и условий реакции. Так, элек-тронодонорные заместители и атомы галогена направляют дальнейшее замещение преимущественно в пара - и орго-положения, однако в более жестких условиях и особенно при катализе хлоридом алюминия происходит изомеризация гомологов бензола с внутримолекулярной миграцией алкильных групп и образованием равновесных смесей, в которых преобладают термодинамически более стабильные изомеры. [17]
Олефины ( II) и ( III) образуются, вероятно, через аллильный карбениевый катион. Сам коричный спирт из-за отсутствия элек-тронодонорных заместителей не подвергается гидрогенолизу. [18]
Ароматические ионы диазония, представляющие собой обычно слабые электрофилы, сочетаются с образованием азосоединений только с сильнонуклеофильными ароматическими соединениями. Замещение проходит обычно в ара-положение к элек-тронодонорному заместителю, а если это положение занято, то в орго-положение. В реакциях сочетания фенолов и аминов важную роль играет кислотность среды. С фенолами реакция проходит быстро только в слабощелочном растворе ( уравнение 113), по-видимому, потому, что неионизированная форма не является обычно достаточно реакционноспособной. Значение рН раствора фенолят-иоиа должно быть не слишком высоким, иначе реакция не пройдет обычным путем, поскольку в достаточно щелочной среде арил-диазониевый ион превращается в соответствующий арилрадикал через диазогидроксид. Тот факт, что сочетание осуществляется в пара-положение даже в кислой среде, означает, что в реакции участвует непротонированный амин. Первичные и вторичные амины часто сочетаются по азоту с образованием триазенов, в особенности, если избегать сильнокислых условий. [19]
Среди реагентов, которые можно классифицировать как слабо элек трофильиые, наиболее изученными являются ионы диазония. Они реагируют только с ароматическими соединениями, имеющими сильные элек-тронодонорные заместители; продуктами реакций являются азосоеди-нения. [20]
При этом, как было показано выше, в изученных рядах мономеров элек-тронодонорные заместители затрудняют электрохимическое восстановление и в то же время повышают скорость радикальной гомополимеризации. Электроноакцепторные заместители оказывают противоположное действие. Таким образом, наблюдается антибатность полярографических потенциалов полуволн и констант скорости полимеризации. [21]
При этом экранирующая способность алкильных радикалов повышается с увеличением их объема, например от метильного к грег-бутиль-ному. Полярность гидроксильной группы в алкилфенолах зависит от характера алкильных заместителей в пара-положении: элек-тронодонорные заместители снижают полярность, а электроноак-цепторные - повышают. Несмотря на то что электронодонорная способность алкильных радикалов в пара-положении возрастает с удлинением цепи ( например, от метильного к грег-бутильному), экспериментальные исследования показали, что наибольшей стабилизирующей активностью обладают алкилфенолы с метальным радикалом в пара-положении к гидроксильной группе. Отсюда можно заключить, что активность алкилфенольных соединений зависит и от других факторов, в частности предполагается, что при окислении определенную роль играют продукты превращения первичных феноксильных радикалов. [22]
Таким образом, константы Гаммета характеризуют величину и знак заряда, который создает заместитель ( в результате индуктивного и ме-зомерного эффектов) у узлового атома бензольного кольца. Электроно-акцепторные заместители, характеризующиеся положительной величиной константы а, создают положительный заряд у узлового атома, элек-тронодонорные заместители с отрицательной величиной а создают отрицательный ( или снижают положительный) заряд у узлового атома. [23]
Накопление алкильных заместителей в циклобутадиеновых комплексах трикарбонила железа уменьшает их устойчивость. Этот факт объясняется большим значением обратной подачи электронов от нульвалентного железа к лиганду для ртабилизации связи металл - циклобутадиен. Наличие элек-тронодонорных заместителей, естественно, затрудняет такое взаимодействие. [24]
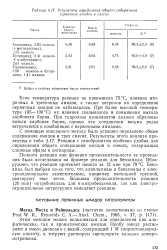 |
Результаты определения общего содержания. [25] |
Полнота реакции как функция продолжительности ее проведения была исследована на примере реакции для бензамида. Обнаружено, что реакция протекает нацело за 12 мин при 70 С. Бенз-амид был выбран из-за того, что алкиламиды и бензамиды с элек-тронодонорными заместителями, например метильыой группой, реагируют еще легче. Большая продолжительность реакции ( 20 мин) потребовалась для / г-нитробензамида, так как электроотрицательная нитрогруппа замедляет реакцию. [26]
 |
Результаты определения общего содержания. [27] |
Полнота реакции как функция продолжительности ее проведения была исследована на примере реакции для бензамида. Обнаружено, что реакция протекает нацело за 12 мин при 70 С. Бенз-амид был выбран из-за того, что алкиламиды и бензамиды с элек-тронодонорными заместителями, например метальной группой, реагируют еще легче. Большая продолжительность реакции ( 20 мин) потребовалась для / г-нитробензамида, так как электроотрицательная нитрогруппа замедляет реакцию. [28]
Электроноакцепторные заместители, уменьшая электронную плотность ароматического ядра, увеличивают положительный заряд на диазогруппе. Это приводит к значительному повышению реакционной способности ди-азокатиона. Например, сульфаниловая кислота является диазосоставляю-щей в синтезах гелиантина и р-нафтолоранжа, нафтионовая кислота - в синтезе красного прочного, п-нитро-анилин-в синтезе n - нитроанилинового красного, антраниловая кислота - в синтезе метилового красного. Элек-тронодонорные заместители влияют в противоположном направлении и уменьшают электрофильную активность диазокатиона. [29]
Легкость атаки электрофильных агентов на атом азота пиридина зависит от электронной плотности у этого атома и стерических препятствий. Сильные электроноакцепторные заместители ( например NO2, COR, C1) затрудняют эти реакции при уменьшении электронной плотности у атома азота. Это влияние является в значительной степени индуктивным и поэтому особенно сильно сказывается из а-положения. Сильные элек-тронодонорные заместители ( например NH2, OR) облегчают элек-трофильную атаку при увеличении электронной плотности у атома азота. Это обусловлено эффектом сопряжения и, следовательно, усиливается в а - и - положениях. Конденсированные - бензольные кольца, арильные и алкильные группы и другие группировки атомов со сравнительно слабым электронным эффектом оказывают небольшое влияние. Указанные эффекты иллюстрируются величиной рКа, приведенной на стр. Реакции другого типа, чем протонное присоединение, затрудняются всеми типами а-групп ( ср. [30]
Страницы: 1 2 3