Фенильный заместитель
Cтраница 2
Рассмотрим конкретный пример - влияние фенильного заместителя на замещение в бензоле. На рис. 9.11 приведены значения коэффициентов в несвязывающих МО для различных уэландовских промежуточных соединений и соответствующие индексы реакционноспособности. [16]
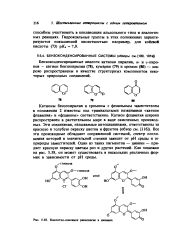 |
Кислотно-основное равновесие в цианине. [17] |
Катионы бензопирилия и хромоны с фенильным заместителем в положении 2 известны под тривиальными названиями катион флавилия и флавоны соответственно. Катион флавилия широко распространен в растительном мире в виде окисленных производных. Все эти производные обладают сопряженной системой, спектр поглощения которой в значительной степени зависит от рН среды и от природы заместителей. Один из таких пигментов - цианин - придает красную окраску цветам роз и других растений. Как показано на рис. 5.58, он может существовать в нескольких различных формах в зависимости от рН среды. [18]
В, для солей с фенильными заместителями лежат около нуля а введение в катион диазения 2 4-динитрофениль - ной группы сдвигает потенциал полуволны до 0, 2 В. [19]
Как ни странно, присутствие второго фенильного заместителя в р-положении вызывает лишь небольшое увеличение скорости. В случае трифенилэтилтозилата наблюдаемый эффект вызывается, по крайней мере частично, уменьшением в карбоний-ионе пространственного напряжения, обусловленного скоплением фе-нильных групп в исходном соединении. Более того, поскольку в конечной смеси могут быть обнаружены только продукты перегруппировки, нельзя исключить возможность прямого образования 1 2 2-трифенилэтил-катиона, причем структура 7.40 соответствует скорее переходному состоянию, чем ионному интерме-диату. [20]
Не удивительно, что введение второго фенильного заместителя настолько уменьшает основность амина, что в воде он уже не проявляет заметных основных свойств. Так, дифениламин нерастворим в разбавленной соляяой кислоте. Введение нитрогруппы в фенильное кольцо анилина понижает его основнссть за счет того, что электроакцепторная группа дестабилизирует ион анилиния ( сопряженную кислоту) и стабилизирует свободное основание. [21]
Реакционная способность также увеличивается с введением электроотрицательного фенильного заместителя. [22]
Присоедияение особенно характерно для оле-финов, имеющих фенильный заместитель. В табл. 3 3 приведены примеры некоторых олефинов, для которых была изучена стереохимия присоединения хлористого или бромистого водорода. [23]
Наоборот, при введении в молекулу фенола фенильного заместителя, не обладающего ни легко расщепляемыми связями, ни положительным индуктивным эффектом ( случай фенияфенола), интенсивность восстановления несколько снижается. [24]
Наоборот, при введении в молекулу фенола фенильного заместителя, не обладающего ни легко расщепляемыми связями, ни положительным индуктивным эффектом ( случай фенилфенола), интенсивность восстановления несколько снижается. [25]
Однако, если метиленовая группа дополнительно активирована, на-дример фенильным заместителем, по ней может проходить алкилирование. [26]
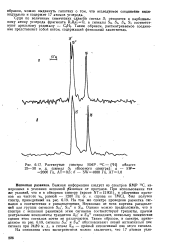 |
Растянутые спектры ЯМР. 13С - Н области. [27] |
Таким образом, рассматриваемое - соединение представляет собой кетон, содержащий фенильный заместитель. [28]
Однако это уменьшение не аддитивно, так как с накоплением числа фенильных заместителей проявляющийся эффект сопряжения частично компенсирует влияние индукционного и стерического эффектов фенильных радикалов. [29]
Реакция гидрогенизации, катализируемая палладием, тормозится не только в результате введения фенильного заместителя, но и добавкой примеси таких феншшроизводных, как изобутилбензол, 1 1-дифенилпро-пан и 1 1 2-трифенилэтан. [30]
Страницы: 1 2 3 4