Фенильный заместитель
Cтраница 3
Устойчивость соединений ( CeH5) aSbX может быть связана с электроноакцепторным характером фенильных заместителей, стабилизирующих связь Sb-X и благоприятствующих тетракоорди-нации. [31]
Введение ме-тильных и этильных заместителей в положение 1 [178-180], а также метальных, этильных, пропильных, бутильных, бензильных и фенильных заместителей в положение 2 [178-182] не оказывает существенного влияния на реакционную способность пиррольного ядра. В табл. 22 приведен список соединений пиррола, электровосстановление которых было изучено. [32]
Смешанные алкано-ареновые углеводороды, вероятно, состоят из длинных алкановых цепей с фенильными заместителями в конце цепи. Число ароматических колец в этих структурах не превышает двух. Подобные углеводороды как с циклоалкановыми, так и фенильными заместителями могут входить в состав твердых парафинов и церезинов. В чистом виде они пока не выделены. Третий тип углеводородов смешанного строения, в молекулах которых имеются все структурные элементы - ареновые, циклоалкановые и алкановые, - наиболее распространен среди углеводородов высокомолекулярной части нефти. [33]
Смешанные парафино-ароматические углеводороды, вероятно, состоят из длинных парафиновых цепей с фенильными заместителями в конце цепи. Число ароматических колец в этих структурах не превышает двух. Подобные углеводороды как с циклопарафи-новыми, так и фенильными заместителями могут входить в состав твердых парафинов и церезинов. В чистом виде они пока не выделены. Третий тип углеводородов смешанного строения, в молекулах которых имеются все структурные элементы - ароматические, циклопарафиновые и парафиновые, - наиболее распространен среди углеводородов высокомолекулярной части нефти. [34]
Температуры застывания кремнийорганических жидкостей класса ПФМС зависят главным образом от содержания в них фенильных заместителей: при Б 1 температуры застывания этих кремнийорганических жидкостей не очень существенно отличаются от таковых для кремнийорганических жидкостей класса ПМС-р, а при е 1 возрастают и могут превышать 293 К. [35]
Изучение бромгидрата петидина Ci5H NO2 - HBr предпринято [118] с целью установления ориентации фенильного заместителя в положении 4 ( рис. 22а), поскольку, как и морфин, это соединение обладает наркотическим действием. Предположение о том, что в молекуле петидина, как и у морфина, фенильное кольцо ориентировано аксиально, опровергнуто данными рентгеноструктурного анализа: оказалось, что фенильное кольцо занимает экваториальную позицию и практически копланарно со связью С2 - С ( з кольца. Группа СН3 при атоме N и связь С ( з - С ( О) находятся в экваториальном положении. [36]
К соединениям первого класса относятся этилен и нек-рые его производные с алкильными или фенильными заместителями, различные полиены, али-фатич. Среди веществ второго класса можно выделить циклопропан, простые циклич. [37]
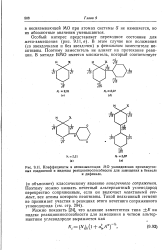 |
Коэффициенты в несвязывающих МО уэландовских промежуточных соединений и индексы реакционноспособности для замещения в бензоле. [38] |
В этом случае все положения ( со звездочками и без звездочек) в фенильном заместителе неактивны. Поэтому заместитель не влияет на протекание реакции. [39]
Карбен XXXIX замыкается исключительно по СС-связи, внедрение в С - Н - связь фенильного заместителя не имеет место. Введение фенильного заместителя к кар-беновому атому в карбене XL, совместно с влиянием подавляющей циклизацию CN-группы при кратной связи, приводит к преимущественному образованию производных индена. Более склонный к внедрению карбен XLI дает лишь инден. [40]
В пентафенилфосфоре ( пл 121 С, дипольный момент равен 0) все пять фенильных заместителей связаны с атомом фосфора ковалентными связями. [41]
В этом случае перегруппировка диена в диенильную систему, вероятно, затруднена из-за присутствия фенильных заместителей. [42]
Ионы CeH5CS и ( М - C6H5CS) обнаруживаются также в масс-спектрах соединений, не содержащих фенильных заместителей у винильной группы, например СбН55СНСН2, C6H5S - СН - СНСНз. [43]
Исследование продуктов полимеризации фенилацетилена [1] показало, что этот мономер образует линейный полиен с преимущественным транс-расположением фенильных заместителей. Нагревание этого полимера сопровождается его дальнейшей деполимеризацией с образованием нерастворимого вещества. По крайней мере до 400 этот процесс происходит без заметного изменения элементного состава. Эти вещества способны подвергаться внутримолекулярной дегидратации с образованием карбоциклических полисопряженных систем. [44]
Это, несомненно, обусловлено относительно высокой стабильностью трифенилметильного аниона, стабилизирующегося за счет сопряжения с фенильными заместителями. [45]
Страницы: 1 2 3 4