Валентность - железо
Cтраница 3
А ( для которых уравнение ( 1) дает порядок связи 0 19); кроме того, приходится принять валентность железа равной 6 вместо первоначальной величины 5 78, а для связей Fe-Si и Fe-Fe использовать различные радиусы атома Fe ( VI) па том основании, что вклад d - электропов в эти связи различен. В дальнейшем было показано [3], что уравнение Полипга не согласуется с межатомными расстояниями при К. Поэтому остается неясным, следует ли использовать это уравнение при обсуждении межатомных расстояний в пптерметаллических соединениях. [31]
Обе полученные соли железа - хлориды железа - обладают различными свойствами, поэтому необходимо дать им названия, которые указывали бы валентность железа. [32]
Титриметрическое определение общего железа предусматривает перевод всего имеющегося в образце железа в одно и то же валентное состояние и последующее титрование, в процессе которого валентность железа меняется. Титрование окисных ионов железа никогда не было общераспространенным, и наиболее широко используются методы, в которых закисное железо при титровании переходит в окисное. [33]
Гемоглобин при помощи железа может присоединять не только кислород, но и окись углерода. Валентность железа при этом тоже не меняется. Ядовитое действие окиси углерода проявляется в том, что образующийся карбоксигемоглобин становится непригодным к переносу кислорода, в результате чего наступает кислородное голодание. При связывании 70 % гемоглобина окисью углерода наступает смерть. [34]
К шестой координационной связи железа цитохрома а могут присоединиться HCN, H2S, CO. При этом валентность железа ( Fe3) становится постоянной и поток электронов прекращается. [35]
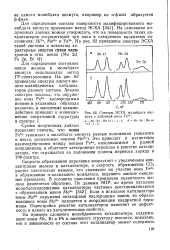 |
Спектры ЭСХА молибдата висмута с добавкой иона Fe3. а - Bi. Fe. Mo 1. 1. 1. б - Bi. Fe. Mo. [36] |
Скорость образования акролеина возрастает с увеличением концентрации железа в катализаторе, а скорость образования СО2 растет значительно меньше, что указывает на участие иона Fe3 в образовании я-аллильного комплекса, ведущего мягкое окисление пропилена. В условиях окисления пропилена валентность железа изменяется обратимо. Если в исходном катализаторе ионы Мо64 окружены октаэдрами кислородных ионов, то образовавшиеся ионы Мо5 находятся в координации квадратной пирамиды. Перестройка решетки катализаторов изменяет ее дефектность и влияет на каталитические свойства. [37]
Однако деструкция их легко протекает как в сильнокислой, так и в сильнощелочной среде. Последнее нами было использовано для установления валентности железа в этих соединениях. С этой целью вещество 66 ( CeH6COC2HN3) 2Fe - H20 в токе азота было обработано 0 02N раствором КОН, приготовленным из перегнанной дважды в токе азота воды. При нагревании наблюдается образование зеленого коллоидного раствора и осадка гидрата закиси железа. Следовательно, в полученном комплексе валентность железа равна двум. [38]
Извлечение железа до седьмого цикла остается почти экви-пропорциональным, а с восьмого цикла оно также частично остается в скелете и не поддается извлечению. Вероятно, здесь играет роль изменение валентности железа и его координационного числа. [40]
В тканях, где содержание кислорода незначительно, кислород отщепляется от гемоглобина. Легкость диссоциации оксигемоглобина объясняется тем, что валентность железа остается всегда постоянной. [41]
Когда такой протопорфирин железа присоединяется к определенному белку, образуется собственно фермент. Связывание происходит, по-видимому, через одну из валентностей железа, а дополнительно и за счет взаимодействия белка с двумя группами пропионовой кислоты протопорфирина. В случае каталазы четыре группы ферригема, или гемина, присоединяются к одной молекуле белка такой величины, что общее содержание железа составляет около 0 1 вес. Каталаза из различных источников или разных видов ( например, бактериальная, печеночная или эритроцитная) может обладать разной активностью. Ферригемы каталазы не легко восстанавливаются до феррогема; действительно, только в последнее время выяснена возможность такого восстановления без разрушения фермента. Фермент пероксидаза также образуется подобным образом путем присоединения ферригема к белку. Весьма отчетливое различие заключается в том, что в пероксидазе имеется только одна группа ферригема на молекулу. Молекула белка также меньше и обладает способностью к соединению с протопорфири-ном марганца без потери пероксидатической активности. Пероксидаза отличается еще тем, что она труднее инактивируется при нагревании, чем каталаза. [42]
Механизм окисления и восстановление цитохромов еще не вполне изучен. Различие между окисленной и восстановленной формами цитохрома с состоит в изменении валентности железа. Функция цитохрома заключается в снятии электрона с атома водорода, активированного дегидразами. Следовательно, цитохром принимает и отдает электроны, являясь переносчиком именно их, а не водорода. В конечном итоге, электроны переносятся на кислород, и последний таким путем приобретает способность вступать в соединение с ионизированным водородом. [43]
Гем, следовательно, принимает участие в окислительно-восстановительных реакциях за счет обратимых изменений валентности железа. [45]
Страницы: 1 2 3 4