Свободная валентность - атом
Cтраница 2
 |
Молекулярные диаграммы для бензола, нафталина и антрацена. [16] |
Цифры на концах стрелок представляют собой индексы свободной валентности атомов, от которых начинаются эти стрелки. Свободная валентность - это новая величина, но по смыслу она близка к таким широкоизвестным понятиям, как остаточное сродство по Вернеру или парциальная валентность по Тиле. Если индекс свободной валентности атома равен нулю, то это означает, что данный атом неспособен к образованию каких-либо новых связей. [17]
Цифры на концах стрелок представляют собой индексы свободной валентности атомов. Числа вдоль линии связей обозначают порядок связи, осуществляемой л-электронами. Цифры около атомов обозначают it - электронную плотность на данном атоме. На молекулярной диаграмме могут быть указаны все перечисленные свойства молекулы или только часть из них. [18]
Лонгет-Хиггинс [ 135 - 135в ] разработали понятие о числе свободной валентности атомов, определяя его как разницу между максимально возможным и реальным связевыми числами. [19]
Ионы обнаруживают во всех отношениях свойства самостоятельных молекул, у которых свободные валентности атомов насыщены электрическими зарядами ( элементарными количествами электричества, электронами), причем соединения веществ с положительными электронами называют катионами, так как при прохождении тока ( при электролизе) они движутся к катоду; соединения же с отрицательными электронами называют анионами, так как при электролизе они направляются к аноду. [20]
Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты ( полностью насыщены) атомами водорода. Члены этого ряда называются гомологами, а сам ряд - гомологическим. [21]
Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты ( полностью насыщены) атомами водорода. [22]
На основе понятия о порядке связи определим еще один структурный индекс - индекс свободной валентности атома ц, обозначаемый Рц, который характеризует степень электронной ненасыщенности атома ( j, субстрата. Для вычисления F найдем вначале сумму порядков всех связей, в которых участвует атом ц данной молекулы. [23]
В результате увеличивается подвижность этого атома водорода и становится возможной его миграция по обобщенной 10-орби-тали на свободную валентность атома углерода, а если анергия системы достаточно высока, то и полный отрыв с выходом в га - 301ВЫЙ объем. Второй атом водорода в этих условиях находится в достаточно устойчивом состоянии, так как его связь с атомом кислорода осталась почти такой же прочности. [24]
Метод резонанса позволяет сравнительно просто оценить распределение зарядов, величину дипольного момента, порядок связи, индекс свободной валентности атома или даже энергию резонанса в молекулах соединений с сопряженными связями и ароматических соединений. Наряду с другими факторами большую роль играет вес или вклад участвующих в резонансе структур, так как вес структуры является переменным параметром, который зависит от произвольного выбора резонирующих структур. Обычно при определении индекса свободной валентности или порядка связи метод резонанса приводит к результатам, сравнимым с результатами расчетов методом МО, но отличающимся по абсолютной величине. [25]
Проведенный анализ показывает, что сравнение температур плавления ингредиентов, конфигураций их молекул, тс-электронной плотности и индекса свободной валентности атомов в молекулах позволяет управлять образованием в бинарных и сложных смесях этих компонентов простых эвтектик, твердых растворов замещения, молекулярных комплексов и полисульфидных соединений, а также определять оптимальные условия получения систем с заранее заданными свойствами. Подобные системы и соединения более эффективны, чем исходные компоненты, так как они обеспечивают большую дефектность и дисперсность кристаллических частиц, а это повышает химическую активность компонентов. [26]
 |
Корреляция направления присоединения дионофила к антрацену. [27] |
В этом случае справедливы рассуждения, рассмотренные в предыдущем разделе и подходящим ИРС должна служить сумма величин индексов свободной валентности атомов, участвующих в образовании связи с диенофилами. [28]
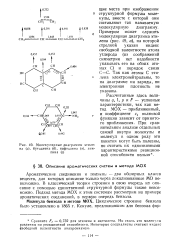 |
Молекулярные диаграммы этилена ( а, бутадиена ( б, нафталина ( в, анилина ( г. [29] |
Примером может служить молекулярная диаграмма этилена ( рис. 49, а), на которой стрелкой указан индекс свободной валентности атома углерода ( из соображений симметрии нет надобности указывать его на обоих атомах С) и порядок связи С-С. Так как атомы С этилена электронейтральны, то на диаграмме ни заряды, ни электронная плотность не указаны. [30]
Страницы: 1 2 3 4