Высокая валентность
Cтраница 1
Высокая валентность обусловливает склонность катионов Э4 к гидролизу с образованием оксокатионов. Чем меньше ионный радиус Э4, тем прочнее удерживается при нем ион кислорода и тем труднее получить ферроцианид негидролизованного катиона. Вследствие этого четырехвалентные катионы могут образовывать в растворах с ионами [ Fe ( CN) e ] 4 - соли как нормального, так и основного типов. [2]
Катионы высокой валентности и низкой координации не склонны давать структуры, полиэдры которых имеют общие ребра или грани. [3]
Присутствие ионов высокой валентности того же знака, что и знак заряда твердой поверхности, вызывает повышение плотности зарядов, которое должно сопровождаться увеличением - потенциала. Однако поскольку при этом одновременно уменьшается толщина двойного слоя, то С-потенциал может уменьшаться, что и наблюдается в некоторых случаях. Если концентрация таких ионов в жидкой фазе достаточно велика, то толщина двойного слоя может настолько уменьшиться, что он в конечном счете исчезнет и образуется новый двойной слой с противоположно заряженными обкладками. Даже если этого исчезновения и не происходит, двойной слой делается настолько тонким, что при большой концентрации ионов - потенциал должен быть мал. Это согласуется с опытом ( см. рис. 125); в присутствии сравнительно больших количеств электролита ( - потенциал стремится к нулю. [4]
Компоненты вещества с высокой валентностью в основном дают окислы с высокими механическими свойствами кристаллогидратов. [5]
Кроме того, благодаря высокой валентности трехвалентных катионов отрицательный заряд алюмосиликатной решетки компенсируется меньшим их числом, в результате чего остается много центров, свободных от ионов металла. Все это обеспечивает высокую активность таких форм цеолитов. [6]
Некоторые элементы проявляют аномально высокую валентность, объясняемую строением их атома. Это, по-видимому, связано с непрочностью 18-электронной оболочки, формирование которой заканчивается в середине большого периода. Для лантанидов характерна высшая положительная валентность 3, соответствующая номеру группы. Однако при начале формирования - оболочки образующие ее электроны связаны не очень прочно. Вследствие этого Се, Рг и отчасти Nd дают соединения, в которых они четырехвалентны. Эта оболочка заполняется в два приема, и электронная конфигурация седьмого элемента гадолиния оказывается наиболее устойчивой. [7]
 |
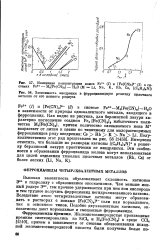
Кривые солидуса в системах Си-Zn, Си-Ga. [8] |
Растворение в меди металла с высокой валентностью ведет к росту числа свободных электронов в кристаллической структуре. Чем выше валентность металла, тем меньшее его количество приводит к достижению концентрации электронов, определяющей границы устойчивости твердого раствора. [9]
Как правило, соли с ионами высокой валентности оказывают большее влияние на растворимость Метоцеля, чем ионы с низкой валентностью. Например, фосфаты и сульфаты оказывают большее влияние на растворимость Метоцеля, чем ацетаты или хлориды. [10]
Их окислы МоО3 и WOa вследствие высокой валентности металла являются ангидридами. Им отвечают в качестве гидратов кислоты: Н2МоО4 - молибденовая и H2WO4 - вольфрамовая. [11]
Мюллер приписывает образование соединений металлов с высокой валентностью, которое имеет место при высокой плотности тока, изменению самого металла. [12]
Нанесение солей, включающих в свой состав металлы высокой валентности, на отработанный алюмосиликат, например A12 ( SO4) 3, Т1 ( МО3) з, СгОз, ( NH4) 2WO4, и последующее их прокаливание на отработанном алюмосиликате при 500 С приводит к восстановлению активности катализатора. Стабильность этих катализаторов высокая. Нанесение окислов ванадия и вольфрама ( из растворов солей) способствует значительному образованию ароматических углеводородов в составе бензинов крекинга, не повышая заметным образом активность исходного катализатора. [13]
Обработка катализатора водородом приводит к восстановлению ионов хрома высокой валентности в ионы Сг3, которые, как хорошо известно, яе являются активными центрами полимеризации. Поэтому ( Сгв 04) 3 - - промежуточный продукт восстановления - по-видимому, не образуется и увеличение каталитической активности не наблюдается. [14]
В некоторых статьях практически количественное извлечение иона А высокой валентности из раствора, содержащего избыток ионов низкой валентности, рассматривается как указание на некоторое специфическое взаимодействие с полом А. Однако уже простое выражение закона действующих масс для равновесия, в котором участвуют иолы различной валентности, показывает, что при уменьшении концентрации иона высшей валентности селективность его поглощения увеличивается. Вместе с обычно наблюдающимся увеличением сродства смолы к катионам по мере возрастания их атомного номера, указанное выше обстоятельство может приводить к очень высоким коэффициентам селективности для трехвалентных катионов по сравнению с одновалентными. [15]
Страницы: 1 2 3 4