Принцип - микроскопическая обратимость
Cтраница 1
Принцип микроскопической обратимости гласит, что, если определенная последовательность стадий способствует протеканию данной прямой реакции, обратная реакция будет состоять из тех же стадий, но их последовательность станет противоположной. [1]
Принцип микроскопической обратимости в применении к химическому процессу есть обычное для химика утверждение, что в равновесной смеси все частные реакции протекают в обоих направлениях с одинаковой скоростью. [2]
Принцип микроскопической обратимости в применении к химическому процессу есть обычное для химика утверждение, что в равновесной, смеси все частные реакции протекают в обоих направлениях с одинаковой скоростью. [3]
Принцип микроскопической обратимости в применении к химическому процессу есть обычное для химика утверждение, что в равновесной смеси все частные реакции протекают в обоих направлениях с одинаковой скоростью. [4]
Принцип микроскопической обратимости или детального равновесия легко выводится из теории переходного состояния, но его трудно вывести каким-либо другим путем. [5]
 |
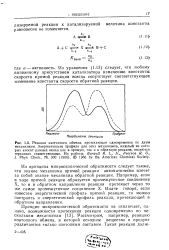
Энергетическая диаграмма стадии развития цепи при хлорировании метана. [6] |
Принцип микроскопической обратимости - обратная реакция должна протекать через то же переходное состояние, что и прямая реакция. Постулат Хэммоида - переходное состояние может быть моделировано или исходными реагентами, или промежуточными соединениями, или конечными продуктами. Лучшей моделью ПС являются частицы, ближайшие по энергии к данному переходному состоянию. [7]
Принцип микроскопической обратимости требует, чтобы водородный обмен протекал только по таким механизмам, по которым возможны также и обратимые реакции. Таким образом, поскольку процессы образования богатых водородом углеводородных адсорбированных состояний редко могут быть подробно прослежены, механизмы водородного обмена в общем остаются неопределенными. [8]
Принцип микроскопической обратимости не разрешает механизм с одним путем реакции, который не симметричен относительно средней точки профиля энергии. Однако он разрешает такой процесс, как механизм с двумя путями, в котором второй путь получается при отражении первого в плоскости, проходящей через среднюю точку. Как показано на рис. 26, в ж г, сумма двух путей симметрична, но атомы-изотопы никогда не становятся эквивалентными. [9]
Поэтому принцип микроскопической обратимости в трактовке его для химических процессов при равновесии выражает принцип детального баланса или детального равновесия [417], самоуравновешивания каждого из этапов, переход по которым компенсируется обратным переходом в исходное состояние обязательно по тому же пути. [10]
Однако принцип микроскопической обратимости может быть использован как основа для исключения, если ни один механизм не известен заранее. Исключение осуществляется благодаря некоторому недостатку симметрии в прямом и обратном направлениях. Доказательство этому легче всего найти в случае реакций изотопного обмена, где, если пренебречь кинетическими изотопными эффектами, механизм должен быть в точности тем же самым для обоих направлений. [11]
Значение принципа микроскопической обратимости в изучении механизмов заключается в том, что любые данные о механизме элементарной реакции могут быть применены к ее обратной реакции. Так как реакции, молекулярность которых выше трех, не встречаются, этот принцип приводит к важному качественному заключению, что реакции, в которых на индивидуальной стадии образуется более трех частиц, являются соответственно невероятными. Например, тетраэтилсвинец разлагается - при нагревании с образованием свинца и этильных радикалов. Однако механизм, вероятно, не должен включать в качестве элементарного процесса реакцию ( 16), так как обратная реакция-в таком случае должна быть пен-тамолекулярной. [12]
Из принципа микроскопической обратимости следует также, что знание механизма прямой реакции автоматически влечет за собой знание механизма обратной реакции. Например, если в ходе прямой реакции образуется промежуточное соединение X, то и в обратном направлении реакция протекает через то же самое промежуточное соединение X. Иначе говоря, если известен энергетический профиль прямой реакции, то можно построить и энергетический профиль реакции, протекающей в обратном направлении. [14]
Принятие принципа микроскопической обратимости позволяет показать неосуществимость равновесий, которые Скрабель [59] называет циркуляционными. [15]
Страницы: 1 2 3 4