Электрохимический принцип
Cтраница 2
Определение главных и побочных компонентов при контроле процесса осуществляется легко вследствие сравнительно больших количеств проб. Для определения в соответствующие места реакционной системы вводят датчики, избирательно отзывающиеся на изменение содержания одного или нескольких компонентов. Здесь предпочтительно находят применение электрохимические принципы анализа, так как они позволяют легко преобразовывать сигналы. [16]
Как известно, для кинетики начального селективного растворения разработан подробный математический аппарат, основанный на теории нестационарной объемной диффузии. Другие же стадии растворения пока еще не получили удовлетворительного кинетического описания. Это составляет задачу нового научного направления, формирующегося на стыке теоретической электрохимии, физико-химии поверхности и металловедения и призванного дать непротиворечивую теорию явлений на границе сплава с коррозионной средой. Очевидно, что, будучи основанной на фундаментальных электрохимических принципах, такая теория должна еще учесть структурно-фазовый состав сплава, строение межфазной границы и приповерхностной зоны, механические напряжения в сплаве и прочее. [17]
Обратимся теперь к той теме электрохимии, которая по своему смыслу как бы противоположна электролизу. Для проведения электролиза необходим внешний источник электрического потенциала, позволяющий осуществлять окислительную и восстановительную реакции на двух электродах. В отличие от этого для создания гальванического элемента выбирают такие электроды и электролитические вещества, которые обладают электрохимической энергией, достаточной для самопроизвольного протекания окислительного и восстановительного процессов. Таким образом, гальванический элемент служит источником электрохимической энергии, и именно по этой причине создаются подобные элементы. Прежде чем перейти к рассмотрению гальванических элементов, имеющих практическое применение, необходимо разобраться в электрохимических принципах их действия. [18]
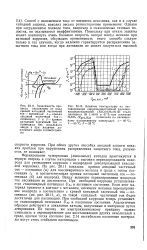
На рис. 20.11 показана кривая анодный частичный ток - потенциал ( а) для пассивируемого металла в среде с током пассивации 1р и соответствующая кривая катодный частичный ток - потенциал ( б) для водорода. Ввиду высокого перенапряжения водорода ток пассивации не достигается. При свободной коррозии устанавливается стационарный потенциал UKa в активном состоянии. Если этот материал привести в контакт с металлом, имеющим меньшее перенапряжение водорода в соответствии с кривой катодный частичный ток - потенциал ( см. рис. 20.11, в), то такой катодный частичный ток будет достаточен для пассивации. Аналогичным образом действуют и локальные катоды, полученные в материале путем легирования. По такому же электрохимическому принципу можно уменьшить и перенапряжение для восстановления других окислителей в среде, причем тогда согласно рис. 2.14 нестабильно пассивные материалы могут стать стабильно пассивными. [20]
Страницы: 1 2